
【题目】当前,汽车尾气已成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下:

下列关于该“消除”过程的叙述不正确的是
A. 部分光能转变为化学能
B. 消除总变化为NOx+O2+H2O→HNO3
C. 消除反应能全天候发生
D. 使用纳米TiO2的消除效率更高
【答案】C
【解析】
由图中示意图可以看出,在TiO2催化作用下,紫外线提供能量,发生化学反应:NOx+O2+H2O→HNO3,纳米TiO2与紫外线接触面积更大,可以提高化学反应速率,据此分析解答。
A. 题中示意图表明,在TiO2的催化作用下紫外线提供能量,部分光能转变为化学能,故A项正确,不符合题意;
B. 题中示意图表明,在TiO2的催化作用下紫外线提供能量,发生反应:NOx+O2+H2O→HNO3,故B项正确,不符合题意;
C.没有紫外线时上述反应不能发生,故C项错误,符合题意;
D.纳米与紫外线接触面积更大,将产生更多的光生电子和光生空穴,从而消除更多的NOx,故D项正确,不符合题意;
答案选C;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(14分)有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。
①A元素最外层电子数是次外层电子数的2倍。
②B的阴离子和C的阳离子与氖原子的电子层结构相同。
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。
⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。
请写出:
(1)A元素的最高价氧化物的电子式 。
(2)B元素在周期表中的位置 。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有 。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的 。
(6)元素D与元素E相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填选项序号)。
a.常温下D的单质和E的单质状态不同
b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要的资源。A~F是常见有机物,它们之间的转化关系如图1所示(部分产物和反应条件已略去),其中A的产量可以用来衡量一个国家的石油化工发展水平,E是最简单的芳香烃。回答下列问题:

(1)石油通过___________________可以得到A。
(2)步骤所用试剂X为___________(写化学式),D的官能团名称是___________;
(3)F的结构简式为_____________,步骤①的反应类型:____________;
(4)写出下列步骤中的化学方程式:
步骤③___________________________________;
步骤④___________________________________;
(5)用图所示实验装置制取乙酸乙酯。请回答:

试管b中所装溶液应为______,乙酸乙酯生成后,分离出产品时的操作方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制480 mL 3 mol· L—1的NaOH溶液,根据这种溶液的配制情况回答下列问题:
(1)配制上述溶液需要用烧杯、玻璃棒外,还需用到的玻璃仪器是__________(填仪器名称)。
(2)用托盘天平称量NaOH固体的质量为_________g,定容时的具体操作为____________________________________________________;
(3)若没有用少量水洗涤烧杯和玻璃棒2~3次,并将每次洗涤液转入容量瓶的操作,会使结果______(填偏高、偏低、无影响,下同),若定容时采用仰视刻度线,则所配制的溶液浓度将__________;
(4)取100 mL 3 mol· L—1的NaOH溶液,缓慢通入标况下6.72 L的CO2气体。反应的离子方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F是几种烃分子的球棍模型(如下图),据此回答下列问题:
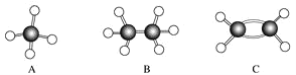
(1)属于同系物的是________;
(2)常温下含碳量最高的气态烃的分子式是____________________________________;
(3)能够发生加成反应的烃有(填数字)________种;
(4)写出C与溴的四氯化碳溶液反应的化学方程式________________;
(5)写出F与溴发生取代反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍具有相似的性质,在化学上称为铁系元素。回答下列问题:
(1)LiCoO2、 LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为_________,第四电离能I4(Co) _________I4(Fe)(填“>”或“<”),PO43-的空间构型为_________。
(2)铁系元素能与CO形成Fe(CO)5、Ni(CO)4等金属羰基配合物。
与CO互为等电子体的分子和离子分别为_________和_________(各举一种,填化学式);在CO分子中,键与π键数目之比为_________。
(3)铁与K2O、 (环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(环戊二烯)在隔绝空气条件下共热可制得二茂铁[Fe(C5H5)2]。在环戊二烯中,C原子的杂化轨道类型为_________。二茂铁熔点为446K,不溶于水,易溶于乙醚、苯、乙醇等有机溶剂,373K即升华;从各种性质看,都表明它是典型的_________化合物。
(4)铁单质的堆积方式有两种,其剖面图分别如图a、b所示。
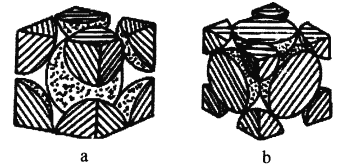
在图a所示堆积方式里铁原子的半径为rpm,则其晶胞棱长为_________cm。
在图b所示堆积方式里铁原子的总体积占晶体体积的比例为_________(用含圆周率π的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关1~18号元素的原子核外电子排布规律的描述正确的是( )
A.最外层电子数为1的金属元素有3种
B.最外层电子数为2的元素一定是金属元素
C.K层与L层电子数之比为1:2的元素有2种
D.最外层电子数为8的元素一定是稀有气体元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com