
 CO2(g)��H2 (g)����H��0
CO2(g)��H2 (g)����H��0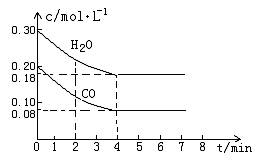

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 N2O4 ( g ) �Ѵﵽƽ�⣬��С���ܱ��������ݻ�������������ɫ�ı仯��
N2O4 ( g ) �Ѵﵽƽ�⣬��С���ܱ��������ݻ�������������ɫ�ı仯��| A������ | B����dz | C���ȱ������Ա�dz | D���ȱ�dz���Ա��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3CH2OH��g��+3H2O��g����
CH3CH2OH��g��+3H2O��g���� �¶ȣ�K�� �¶ȣ�K��CO2ת���ʣ�%�� n��H2��/n��CO2�� | 500 | 600 | 700 | 800 |
| 1��5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
 CH3OH��g��+H2O��g����2minĩ�÷�Ӧ�ﵽƽ�⣬���CH30H��Ũ��Ϊ0��2mol��L�������жϲ���ȷ����___ _��
CH3OH��g��+H2O��g����2minĩ�÷�Ӧ�ﵽƽ�⣬���CH30H��Ũ��Ϊ0��2mol��L�������жϲ���ȷ����___ _��

 ��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ
��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ �������ɳ�������CaCl2��Һ����СŨ��Ϊ ��
�������ɳ�������CaCl2��Һ����СŨ��Ϊ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3�ﵽƽ��״̬�ı�־��
2SO3�ﵽƽ��״̬�ı�־��| A��������SO2��O2��SO3�ķ�����֮��Ϊ2�s1�s2 |
| B����λʱ��������nmol SO3��ͬʱ����n/2mol O2 |
| C�������ڵ�ѹǿ����ʱ����仯 |
| D������SO3������O2��������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����Ƶ���ˮ�ڹ�����������ɫ��dz |
| B��H2��I2��HIƽ��������ѹ����ɫ���� |
| C��KI��Һ����ˮ����ɫ���� |
| D��������������ڰ������ķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 N2O4(g)����ƽ��ʱ������������ͨ��һ������NO2(g)���ش�ƽ������һ��ƽ��ʱ��ȣ�NO2����������� ��
N2O4(g)����ƽ��ʱ������������ͨ��һ������NO2(g)���ش�ƽ������һ��ƽ��ʱ��ȣ�NO2����������� ��| A������ | B������ | C����С | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC(g)+qD(g)
pC(g)+qD(g)  ��0��������������ȷ����( )
��0��������������ȷ����( )
 =q
=q
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com