
【题目】醇酸树脂固化成膜后具有良好的耐磨性和绝缘性,下面是一种成膜性良好的醇酸树脂的合成路线,如下图所示:
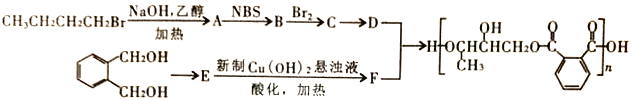
已知:①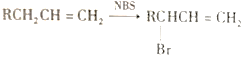 ②RCH=CH2
②RCH=CH2![]() RCH2CH2Br
RCH2CH2Br
(1)A的化学名称为________________,E中官能团的名称是__________________。
(2)B的结构简式为_______________,C制备D的反应条件是_____________,制备E的反应类型是_______________________。
(3)下列说法正确的是_________。
A.D是甘油的同系物
B.C是不溶于水的油状液体
C.F不能与新制氢氧化铜悬浊液反应
D.只用硝酸银溶液,就可以检出CH3CH2CH2CH2Br中是否含有溴原子
(4)写出D、F在一定条件下反应生成醇酸树脂的化学方程式________________________。
(5)芳香族化合物X是![]() 的同分异构体,X遇FeCl3溶液显紫色,可发生消去反应,其核磁共振氢谱显示有6 种不同化学环境的氢,峰面积比为1∶1∶1∶2∶2∶3。写出符合要求的X的结构简式________________。
的同分异构体,X遇FeCl3溶液显紫色,可发生消去反应,其核磁共振氢谱显示有6 种不同化学环境的氢,峰面积比为1∶1∶1∶2∶2∶3。写出符合要求的X的结构简式________________。
(6)请参考本题信息写出以CH3CH=CH2为原料制备化合物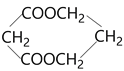 的合成线路流程图(无机试剂任选)。_______________
的合成线路流程图(无机试剂任选)。_______________
【答案】 1-丁烯 醛基 CH3CHBrCH=CH2 氢氧化钠水溶液、加热 氧化反应 AB 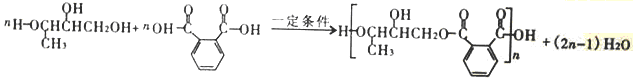
![]()

【解析】CH3CH2CH2CH2Br在氢氧化钠醇溶液作用下消去得到A(CH3CH2CH=CH2),根据题目已知的反应①,A与NBS作用应该在双键下一个碳原子上取代一个Br,所以得到有机物B(CH3CHBrCH=CH2),B与单质溴发生加成得到C(CH3CHBrCHBrCH2Br),根据最后得到的高分子化合物,判断出来,C发生水解得到D(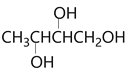 )。E能与新制氢氧化铜反应,说E有醛基,所以E为
)。E能与新制氢氧化铜反应,说E有醛基,所以E为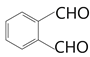 ,E被氧化后酸化得到F(
,E被氧化后酸化得到F(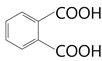 ),最后F和D发生缩聚反应得到最终的高分子树脂。
),最后F和D发生缩聚反应得到最终的高分子树脂。
由上可得:
(1)A的名称为1-丁烯。E为 ,含有的官能团为醛基。
,含有的官能团为醛基。
(2)B为CH3CHBrCH=CH2,C到D是发生卤代烃的水解反应,所以反应条件为氢氧化钠水溶液、加热。由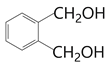 制备
制备 的反应是氧化反应。
的反应是氧化反应。
(3)D为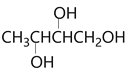 ,甘油是丙三醇,两者的官能团的种类和数目相同,分子组成相差一个CH2,所以两者互为同系物,选项A正确。C是三溴代丁烷,一般来说多卤代烃多为无色不溶于水的液体,选项B正确。F为
,甘油是丙三醇,两者的官能团的种类和数目相同,分子组成相差一个CH2,所以两者互为同系物,选项A正确。C是三溴代丁烷,一般来说多卤代烃多为无色不溶于水的液体,选项B正确。F为 ,属于二元酸,应该能与新制氢氧化铜悬浊液发生中和反应,选项C错误。CH3CH2CH2CH2Br不溶于水,不会电离出溴离子,所以加入硝酸银溶液也不会有沉淀生成,所以选项D错误。
,属于二元酸,应该能与新制氢氧化铜悬浊液发生中和反应,选项C错误。CH3CH2CH2CH2Br不溶于水,不会电离出溴离子,所以加入硝酸银溶液也不会有沉淀生成,所以选项D错误。
(4)D和F发生缩聚反应,得到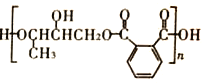 ,所以方程式为:
,所以方程式为:
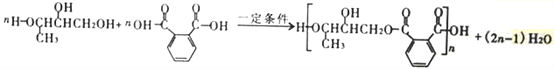
(5)X遇FeCl3溶液显紫色,说明X中有酚羟基;可发生消去反应,说明X中有可以消去的醇羟基,其核磁共振氢谱显示有6 种不同化学环境的氢,峰面积比为1∶1∶1∶2∶2∶3,说明分子中一定有甲基。得到X有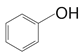 的结构单元,X中另外还有-OH和-CH3,因为与
的结构单元,X中另外还有-OH和-CH3,因为与 互为同分异构体,所以X中另外还有一个饱和碳,为了保证羟基能消去,则一定有
互为同分异构体,所以X中另外还有一个饱和碳,为了保证羟基能消去,则一定有![]() ,再根据核磁共振氢谱的结果,得到两个取代基互为对位,结构简式为
,再根据核磁共振氢谱的结果,得到两个取代基互为对位,结构简式为![]() 。
。
(6)明显如果想得到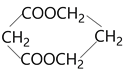 ,应该得到HOOC-CH2-COOH 和HOCH2-CH2-CH2OH,将两者酯化即可。而HOOC-CH2-COOH 可由HOCH2-CH2-CH2OH氧化得到,HOCH2-CH2-CH2OH应该由BrCH2-CH2-CH2Br水解得到。将丙烯先与NBS做取代,再与HBr加成(根据题目已知②用过氧化氢控制加成的方向)就能得到BrCH2-CH2-CH2Br。所以合成的路线为:
,应该得到HOOC-CH2-COOH 和HOCH2-CH2-CH2OH,将两者酯化即可。而HOOC-CH2-COOH 可由HOCH2-CH2-CH2OH氧化得到,HOCH2-CH2-CH2OH应该由BrCH2-CH2-CH2Br水解得到。将丙烯先与NBS做取代,再与HBr加成(根据题目已知②用过氧化氢控制加成的方向)就能得到BrCH2-CH2-CH2Br。所以合成的路线为:



科目:高中化学 来源: 题型:
【题目】(1)标况下5.6L的CO2质量为 _____g,其中含有______个分子,含有_____个原子;
(2)质量均为m g的 HCl、NH3、CO2、O2四种气体,所含分子数目最少的是_________,体积最大的是_____,密度最小的是_______(在相同温度和压强条件下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是__________(填物理变化、化学变化);
(2)实验室用MnO2和浓盐酸为原料制备氯气,该反应的化学方程式为________________________________,其中氧化剂是_______还原剂是________。尾气处理的离子方程式为______________________________。
(3)工业上制备漂白粉的化学方程式___________________________________。
(4)将实验室制的氯气配成新制的氯水含有多种微粒,试用方程式或化学式回答下列问题:
将氯水滴加紫色石蕊溶液中,先变红后褪色______________________________(化学方程式)其中,变红后褪色是因为有_________(化学式)生成具有漂白性;
将氯水滴入硝酸银溶液中,有白色沉淀生成__________________________。(离子方程式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏实验装置。
(1)写出下列仪器的名称:a.__________; b.___________;
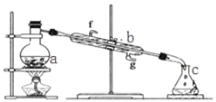
(2)实验过程中,需要通冷水,图中的进水方向是_______进(填图中字母);
(3)若利用装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77℃)的混合物,还缺少的仪器是_______;
II.现用NaOH固体配制0.1 mol/L NaOH溶液480mL,据此回答下列问题:
(4)配制氢氧化钠溶液需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和______;
(5)实验时需要称量氢氧化钠_______g;
(6)配制0.1 mol/L NaOH溶液的实验中,如果出现以下操作,会导致配制溶液的浓度偏大的有_______(填写字母)。
A.称量氢氧化钠固体时砝码放反了 B.未洗涤溶解NaOH的烧杯
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.容量瓶未干燥即用来配制溶液 E.定容时俯视刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Fe2+﹑NO3-﹑NH4+﹑Fe3+、H+- H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
A. 若有1mol NO3-参加还原反应,则转移8mole- B. 还原产物为NH4+
C. 氧化剂与还原剂的物质的量之比为8:1 D. 该反应中Fe2+被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。
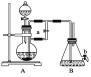
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是___________________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为__________________。
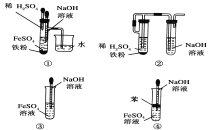
(5)下图中________能较长时间看到Fe(OH)2白色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.阅读、分析下列两个材料:
材料一
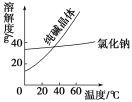
材料二
物质 | 熔点/℃ | 沸点/℃ | 密度/ g/cm3 | 溶解性 |
乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填字母序号):
(1)从含少量NaCl的Na2CO3中提纯Na2CO3的操作为溶解、_________、________、过滤、洗涤、干燥
(2)将乙二醇和丙三醇相互分离的最佳方法是_________。
A.蒸馏法 B.萃取法 C.结晶法 D.分液法
II.青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下
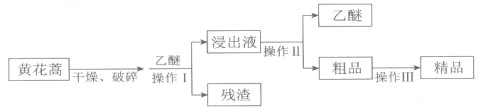
操作I、II中,不会用到的装置是________(填序号)。
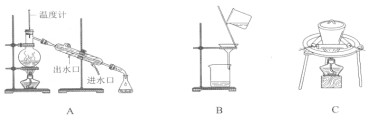
Ⅲ.实验室用98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的H2SO4溶液470mL.
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、___________、__________。
(2)其操作步骤可分解为以下几步:
A.用量筒量取______mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):____________
( D )→( A )→ → → → →( F )。
(3)下列操作会使所配稀硫酸浓度偏高的是______________。
A、取用浓硫酸时仰视刻度线
B、容量瓶用蒸馏水洗涤后用1.2mol/L的硫酸润洗
C、转移溶液时,不慎有少量溶液洒出
D、定容时仰视容量瓶刻度线
E、将稀释后的稀硫酸立即转入容量瓶且进行后面的实验操作
F、定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴 蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是( )
A.离子化合物中只含离子键
B.共价化合物一定不含离子键
C.离子化合物一定不含共价键
D.共价化合物可能含有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com