
已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大,X基态原子的核外电子分布在3 个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和。另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,请回答下列问题。
(1)微粒XZ32-的中心原子杂化类型为 化合物YW3的空间构型为 。
(2)R基态原子的电子排布式为 ,元素X、Y、Z的第一电离能由大到小的顺序为
(用元素符号表示)。
(3)一种新型导体晶体的晶胞如右图所示,则该晶体的化学式为 ,其中一个Q原子紧邻 个R原子。

(4)R的氢氧化物能溶于含XY-离子的溶液生成一种配离子[R(XY)4]2-,该反应的离子方程式是 弱酸HXY分子中存在的σ键与 键的数目之比为
。
键的数目之比为
。
(16分,每空2分)(1)sp2 三角锥形 (2)1s22s22p63s23p63d84s2 或[Ar]3d84s2 N>O>C
(3)MgNi3C 12 (4)Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH- 1:1
【解析】
试题分析:X基态原子的核外电子分布在3 个能级,且各能级电子数相等,这说明X的原子序数是2+2+2=6,因此X是碳元素。Z是地壳中含量最多的元素,则Z是氧元素;Y的原子序数介于X与Z之间,所以Y是氮元素。W是电负性最大的元素,所以W是氟元素。元素Q的核电荷数等于Y、W原子的最外层电子数之和,因此Q的原子序数=5+7=12,则Q是镁元素。另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,所以R是镍元素。
(1)微粒XZ32-是CO32-,中心原子碳原子含有的孤对电子对数=(4+2-3×2)÷2=0,所以该微粒的空间构型是平面正三角形,则碳原子杂化类型为 sp2杂化;化合物YW3是NF3,根据价层电子对互斥理论可知,中心原子N原子含有的孤对电子对数=(5-3×1)÷2=1,因此NF3分子空间构型为三角锥形结构。
(2)根据构造原理可知,镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2 或[Ar]3d84s2;同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以元素X、Y、Z的第一电离能由大到小的顺序为N>O>C。
(3)根据晶胞结构并依据均摊法可知,晶胞Mg原子的个数=8×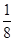 =1个;Ni原子的个数=6×
=1个;Ni原子的个数=6×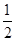 =3个;碳原子的个数=1个,所以其化学式为MgNi3C。由于顶点被周围的8个正方体共用,所以根据晶胞结构可判断一个Mg原子紧邻(3×8)÷2=12个Ni原子。
=3个;碳原子的个数=1个,所以其化学式为MgNi3C。由于顶点被周围的8个正方体共用,所以根据晶胞结构可判断一个Mg原子紧邻(3×8)÷2=12个Ni原子。
4)R的氢氧化物Ni(OH)2能溶于含CN-离子的溶液生成一种配离子[Ni(CN)4]2-,其中CN-是配体,因此反应的离子方程式是Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH-。HCN分子中含有1个碳氢单键和1个碳氮三键,由于单键是σ键,三键是由1个σ键与2个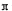 键构成的,所以化合物HCN分子中存在的σ键与
键构成的,所以化合物HCN分子中存在的σ键与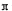 键的数目之比为2:2=1:1。
键的数目之比为2:2=1:1。
考点:考查核外电子排布、杂化轨道、空间构型、电负性、共价键、配位健以及晶体结构与化学式判断等


科目:高中化学 来源:2011-2012学年吉林长春外国语学校高一下学期3月月考文科化学试卷(带解析) 题型:填空题
已知元素X、Y、Z、W的原子序数分别为6、8、11,请回答:
(1)它们各是什么元素?
(2)不看周期表,你如何来推断它们在周期表中的位置(周期和族)?
查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃省武威五中高一下学期期末考试化学试卷(带解析) 题型:填空题
(14)已知元素X、Y、Z、W的原子序数分别为6、8、11、13,请回答:
(1)写出下列元素符号X Y Z W
(2)写出下列元素在周期表中的位置X Y
Z W
(3)写出下列反应方程式:X+Y
Z+Y W+Y
查看答案和解析>>
科目:高中化学 来源:2015届河南灵宝市高一下第三次检测文科化学卷(解析版) 题型:填空题
已知元素X、Y、Z、W的原子序数分别为6、8、11、13,请回答:
(1)写出下列元素符号X Y Z W
(2)写出下列元素在周期表中的位置X Y
Z W
查看答案和解析>>
科目:高中化学 来源:2014届甘肃省高一下学期期末考试化学试卷(解析版) 题型:填空题
(14)已知元素X、Y、Z、W的原子序数分别为6、8、11、13,请回答:
(1)写出下列元素符号X Y Z W
(2)写出下列元素在周期表中的位置X Y
Z W
(3)写出下列反应方程式:X+Y
Z+Y W+Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com