
【题目】某兴趣小组的同学发现,将CuSO4溶液与K2CO3溶液混合会产生蓝绿色沉淀,它们对沉淀的组成和兴趣,决定采用实验大方法进行探究。
(1)【提出猜想】
猜想1:所得沉淀为Cu(OH)2;
猜想2:所得沉淀为______________________;(填化学式)
猜想3:所得沉淀为碱式碳酸铜[化学式可表示为mCu(OH)2·nCuCO3]。
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画)进行定性实验;
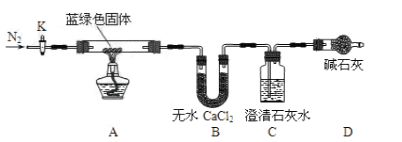
(2)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设________成立。
(3)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是_______(填代号)。
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(4)乙同学验证假设3成立的实验现象是______________。
【定量探究】
(5)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在常温时的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是__________(填代号)。
溶解度(S)/p | 溶度积(Ksp) | 摩尔质量(M)/g·mol | |||
Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
A.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为27.1g,实验结束后,装置B的质量增加2.7g,C中产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为__________;A中发生反应的化学方程式为_____。
【答案】 CuCO3 1 B A中蓝绿色固体变黑色,B中无水CuSO4固体变蓝,C中有白色沉淀产 AC 2CuCO3·3Cu(OH)2、或3Cu(OH)2·2CuCO3或Cu5(OH)6(CO3)2 2CuCO3·3Cu(OH)2![]() 5CuO + 3H2O↑ + 2CO2↑
5CuO + 3H2O↑ + 2CO2↑
【解析】(1)CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,氢氧化铜和碳酸铜都是蓝色沉淀,可能是反应复分解反应生成了碳酸铜沉淀,或双水解生成了氢氧化铜沉淀,或碱式碳酸铜,假设1中沉淀为Cu(OH)2 ,假设2为CuCO3;(2)加热氢氧化铜生成水蒸气和黑色氧化铜,加热碳酸铜分解生成二氧化碳和黑色氧化铜,二氧化碳能使澄清的石灰水变浑浊,若反应后A中蓝绿色固体变黑,C中澄清石灰水不变浑,证明一定不含有碳酸铜,现象的产生为氢氧化铜,假设1正确。(3)加热氢氧化铜生成水蒸气和黑色氧化铜,加热碳酸铜分解生成二氧化碳和黑色氧化铜,二氧化碳能使澄清的石灰水变浑浊,所以需要验证水的存在和二氧化碳的存在就可以证明产生的物质成分,装置A中加热是否变化为黑色固体,装置B选择无水硫酸铜验证是否生成水,澄清石灰水是否变浑浊证明是否生成二氧化碳,故选B即可。(4)假设3:所得沉淀为碱式碳酸铜[化学式可表示为 m Cu(OH)2nCuCO3],氢氧化铜、碳酸铜分解,装置A中加热都会变化为黑色固体,装置B选择无水硫酸铜,根据是否变蓝色验证是否生成水,根据装置C中澄清石灰水是否变浑浊证明是否生成二氧化碳,所以证明假设是否正确的现象为:A中蓝绿色固体变黑色说明氢氧化铜、碳酸铜分解,B中无水CuSO4固体变蓝说明存在Cu(OH)2 ,C中有白色沉淀产生说明存在CuCO3,即能验证假设3成立,即A 中蓝绿色固体变黑色, B 中无水 CuSO4 固体变蓝, C 中有白色沉淀产生。(5)① A、Ba(OH)2 溶解度大于Ca(OH)2,能充分吸收 CO2,故A正确;B、氢氧化钙也为强碱,故B错误;C、BaCO3的摩尔质量大于CaCO3,测量误差小,故C正确;D、CaCO3的溶解度和BaCO3溶解度相差不大,故D错误。故选AC。②B中吸收水的物质的量n=2.7g/18g·mol-1=0.15mol,C中吸收二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒二氧化碳的物质的量=19.7g/197g·mol-1=0.1mol,氧化铜的物质的量=(27.1g-2.7g-0.1mol×44g·mol-1)/80g·mol-1=0.25mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25mol:0.3mol:0.1mol=5:6:2,所以其化学式为:2CuCO33Cu(OH)2或 3Cu(OH)22CuCO3 或 Cu5(OH)6(CO3)2 ,2CuCO33Cu(OH)2受热分解生成CuO、二氧化碳和水,其反应的方程为:2CuCO33Cu(OH) ![]() 5CuO+3H2O↑+2CO2↑ 。
5CuO+3H2O↑+2CO2↑ 。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子,因发生氧化还原反应而不能大量共存的是
A. K+、Fe3+、SCN–、Cl– B. Fe3+、K+、OH–、SO42–
C. Fe2+、K+、Cl–、MnO4– D. Na+、H+、SO42–、CO32–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明的中性溶液中:Fe3+、Ba2+、NO3-、Cl-
B.使甲基橙变黄色的溶液中: Na+、AlO2-、SO42-、Cl-
C.c(OH–)=1×10-13mol/L的溶液中: NH4+、Ca2+、Cl-、NO3-
D.能使红色石蕊试纸变为蓝色的溶液:Na+、Cl、S2、ClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,一容器装满氢气时总质量为61g,若装满氮气时总质量为74 g,则容器的容积为
A. 11.2 L B. 44.8 L C. 33.6 L D. 22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.
Ⅰ:下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)装置B中饱和食盐水的作用是____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入__________。
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
II:制备高铁酸钾的方法有干法和湿法。
(3)干法制备高铁酸钾的主要反应为:
2FeSO4+ 6Na2O2= 2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑
①该反应中的还原剂是_______,每生成lmolNa2FeO4转移____个电子。
②简要说明K2FeO4作为水处理剂时所起的作用________________________________,
(4)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色溶液中能大量共存离子组的是( )
A.Cu2+、Cl-、SO42-、K+B.Ca2+、HCO3-、Cl-、Na+
C.K+、OH-、HCO3-、Na+D.Ag+、NO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应 2A2+3B2=2C 来说,以下表示中,反应速率最快的是( )
A. v(B2)=0.8 mol/ (L·s) B. v(A2)=0.4 mol/ (L·s)
C. v(A2)=0.7 mol/ (L·s) D. v(C)=0.6 mol/ (L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com