
一定条件下,反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H =-a kJ·mol-1,在5 L密闭容器中进行,10 s时达到平衡,水蒸气的物质的量增加了0.6 mol,则下列说法正确的是( )
4NO(g)+6H2O(g) △H =-a kJ·mol-1,在5 L密闭容器中进行,10 s时达到平衡,水蒸气的物质的量增加了0.6 mol,则下列说法正确的是( )
A.第10s时,H2O的反应速率为0.012 mol·Lˉ1·sˉ1
B.10s内,NH3的平均反应速率为0.48 mol·Lˉ1·minˉ1
C.10s内,反应放出的热量为a kJ
D.这10s内,O2的反应速率逐渐减小,NO的反应速率逐渐增大
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
下列关于实验的描述中,正确的是( )
A. 用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性
B. 中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须干燥或用待装液润洗后方可使用
C. 将碘水倒入分液漏斗,加入适量乙醇,振荡后静置,能将碘萃取到乙醇中
D. 向含FeCl2杂质的FeCl3溶液中通是量Cl2后,充分加热蒸干,得到纯净的FeCl3固体
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期阶段考二化学试卷(解析版) 题型:推断题
已知:通常状况下甲、乙、丙、丁为气体单质,A、B、C 、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③是工业制H的重要化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。请回答下列问题:
、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③是工业制H的重要化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。请回答下列问题:

(1)请指出G的颜色和状态 。单质乙的电子式为 。D属于 (填“离子化合物”或“共价化合物”)
(2)B和E在一定条件下可发生反 应,该反应具有实际意义,可消除E对环境的污染,该反应中氧化产物与还原产物的物质的量之比为 。
应,该反应具有实际意义,可消除E对环境的污染,该反应中氧化产物与还原产物的物质的量之比为 。
(3)惰性电极电解A和D的混合溶液,可生成丁单质和一种二元化合物M(与甲、乙所含元素相同),M为三角锥形分子,该反应的方程式为 。在碱性溶液中M与NaClO2(亚氯酸钠)按物质的量之比1∶6恰好反应可生成化合物B和消毒剂ClO2气体,该反应的离子方程式为 。
(4)反应④的化学方程式为  。
。
(5)将Fe、FeO、Fe3O4的混合物二等分 ,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解,且放出336mL(标况下)的气体,向所得溶液中加入KSCN溶液,溶液不变红;另一份混合物加入1 mol/ L 的H溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,则所加入的H溶液的体积是
,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解,且放出336mL(标况下)的气体,向所得溶液中加入KSCN溶液,溶液不变红;另一份混合物加入1 mol/ L 的H溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,则所加入的H溶液的体积是  mL。
mL。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期阶段考二化学试卷(解析版) 题型:选择题
甲 乙为单质, 丙 丁为氧化物,它们存在如下转变
丙 丁为氧化物,它们存在如下转变
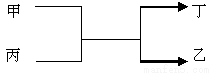
满足条件的乙为① Fe ② Cu ③ Al ④ Mg ⑤ Si ( )
A.①② B.①②⑤ C.①②③⑤ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:填空题
按要求书写方程式
(1)高温下铝与氧化铁反应的化学方程式 。
(2)惰性电极电解AgNO3溶液的离子方程式 。
(3)工业制硝酸吸收塔中发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:选择题
反应A+B→C分两步进行: ①A+B→X, ②X→C, 反应过程中能量变化如图所示, E1表示反应A+B→X的活化能。下列有关叙述不正确的是( )
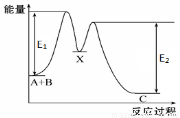
A.反应A+B→X的△H >0
B.反应A+B→C的△H = E1-E2
C.E2表示反应C→X的活化能
D.X是反应A+B→C的中间产物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:填空题
在一定温度下有甲、乙两容积相等的密闭容器(两容器容积保持不变)。
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3 amol。此时,NH3的物质的量分数是_____________。(用含有“a”的表达式表示)。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将_____________(选填“增大”、“减小”或“不变”)。
(2) 若起始时,向乙中通入6mol N2和8mol H2,达到平衡时,生成的NH3的物质的量为b mol,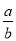
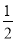 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
下列关于反应能量的说法正确的是 ( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,则反应物总能量>生成物总能量
B.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2
C.101 kPa时,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,则H2的燃烧热为571.6 kJ·mol-1
D.H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则1 mol的氢氧化钠固体与含0.5 mol H2SO4的溶液混合后放出57.3 kJ的热量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上期中化学试卷(解析版) 题型:选择题
常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液(设混合后溶液体积等于混合前两液体体积之和),两者pH都升高了1,则加入水和加入NaOH溶液的体积比约为( )
A.11:1 B.10:1 C.6:1 D.5:1
B.10:1 C.6:1 D.5:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com