
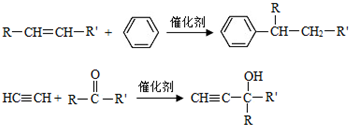
 (-R、-R′代表烃基或-H)
(-R、-R′代表烃基或-H)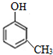 ,“E→F”的反应类型为加成反应.
,“E→F”的反应类型为加成反应.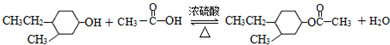 .
.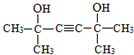 .
.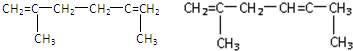 .
.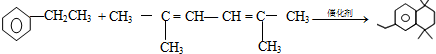 .
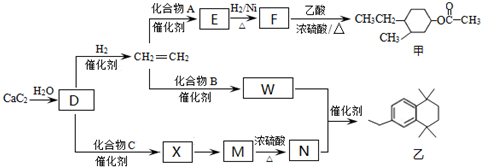
. 分析 碳化钙与水反应生成A为CH≡CH,乙炔与氢气发生加成反应生成乙烯,由甲的结构,逆推可知F为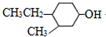 ,乙烯与A反应得到E,E与氢气发生加成反应生成F,化合物A能与浓溴水反应产生白色沉淀,则A为
,乙烯与A反应得到E,E与氢气发生加成反应生成F,化合物A能与浓溴水反应产生白色沉淀,则A为 ,E为
,E为 .化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢,则C为
.化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢,则C为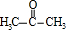 ,W与N发生信息中的加成反应生成乙,化合物W的相对分子质量为106,M、N中均只含一种官能团,N中含有四个甲基,结合乙的结构简式,可知W为
,W与N发生信息中的加成反应生成乙,化合物W的相对分子质量为106,M、N中均只含一种官能团,N中含有四个甲基,结合乙的结构简式,可知W为 ,则B为
,则B为 ,N为(CH3)2C=CH-CH=C(CH3)2,故2分子丙酮与乙炔发生加成反应生成X为
,N为(CH3)2C=CH-CH=C(CH3)2,故2分子丙酮与乙炔发生加成反应生成X为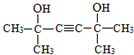 ,X与氢气发生加成反应生成M为
,X与氢气发生加成反应生成M为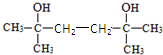 ,M发生消去反应得到N,据此答题.
,M发生消去反应得到N,据此答题.
解答 解:碳化钙与水反应生成A为CH≡CH,乙炔与氢气发生加成反应生成乙烯,由甲的结构,逆推可知F为 ,乙烯与A反应得到E,E与氢气发生加成反应生成F,化合物A能与浓溴水反应产生白色沉淀,则A为
,乙烯与A反应得到E,E与氢气发生加成反应生成F,化合物A能与浓溴水反应产生白色沉淀,则A为 ,E为
,E为 .化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢,则C为
.化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢,则C为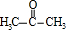 ,W与N发生信息中的加成反应生成乙,化合物W的相对分子质量为106,M、N中均只含一种官能团,N中含有四个甲基,结合乙的结构简式,可知W为
,W与N发生信息中的加成反应生成乙,化合物W的相对分子质量为106,M、N中均只含一种官能团,N中含有四个甲基,结合乙的结构简式,可知W为 ,则B为
,则B为 ,N为(CH3)2C=CH-CH=C(CH3)2,故2分子丙酮与乙炔发生加成反应生成X为
,N为(CH3)2C=CH-CH=C(CH3)2,故2分子丙酮与乙炔发生加成反应生成X为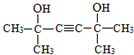 ,X与氢气发生加成反应生成M为
,X与氢气发生加成反应生成M为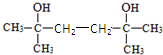 ,M发生消去反应得到N.
,M发生消去反应得到N.
(1)D的结构简式是CH≡CH,由D合成导电高分子物质的化学名称是聚乙炔,
故答案为:聚乙炔;
(2)根据上面的分析可知,A为 ,“E→F”的反应类型是:加成反应,
,“E→F”的反应类型是:加成反应,
故答案为: ;加成反应;
;加成反应;
(3)“F→有机化合物甲”的化学方程式是: ,
,
故答案为: ;
;
(4)W为 ,B为
,B为 ,乙苯能使酸性KMnO4溶液褪色,而苯不能,所以可以用酸性KMnO4溶液鉴别它们,
,乙苯能使酸性KMnO4溶液褪色,而苯不能,所以可以用酸性KMnO4溶液鉴别它们,
故答案为:酸性KMnO4溶液;
(5)①由上述分析可知,X的结构简式是: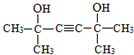 ,故答案为:
,故答案为: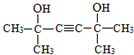 ;
;
②满足合成路线的N的同分异构体是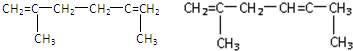 ,
,
故答案为: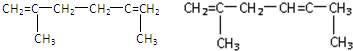 .
.
③N+W→乙的化学方程式为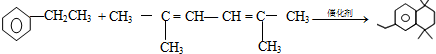 ,
,
故答案为: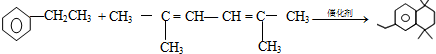 .
.
点评 本题考查有机物的推断与合成,根据甲与乙的结构、结合问题中物质的结构特点进行推断,注意对给予的反应信息的理解,侧重考查学生分析推理能力.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:推断题
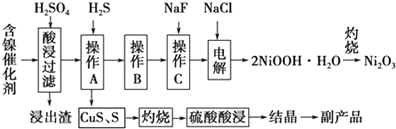
| 氢氧化物 | Fe(OH)3 | Fe(OH)2[来 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
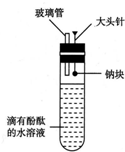 有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:
有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3(MnO2,加热) | B. | KMnO4(加热) | C. | H2O2(MnO2) | D. | HgO(加热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 作净水剂的明矾和作消毒剂的漂白粉都是强电解质 | |
| B. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 合成氨生产中将NH3液化分离,虽可提高N2、H2的转化率但减小了反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
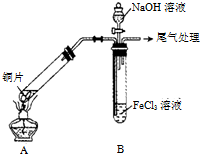 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3 NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过测定沸点区别生物柴油和矿物柴油 | |
| B. | 用水区别乙酸、溴苯和硝基苯 | |
| C. | 用溴水区别环己烷、甲苯和环己烯 | |
| D. | 用燃烧法区别乙醇、苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com