
【题目】一种碳纳米管能够吸附氢气,用这种材料吸氢后制备的二次电池(充放电电池)工作原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液,下列说法中正确的是

A.放电时K+移向碳电极
B.放电时电池负极的电极反应为H2-2e-= 2H+
C.充电时镍电极的电极反应为Ni(OH)2 + OH――e-= NiO(OH) + H2O
D.该电池充电时将碳电极与电源的正极相连,发生氧化反应
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
【题目】某硝酸厂处理尾气中NO的方法是在催化剂存在时用H2将NO还原为N2:NO(g)+H2(g)=== ![]() N2(g)+H2O(g) ΔH=m kJ·mol-1,其能量变化过程如下:
N2(g)+H2O(g) ΔH=m kJ·mol-1,其能量变化过程如下:
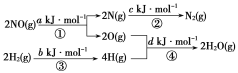
下列说法正确的是( )
A.过程①②③④都是放热过程
B.m=+![]() (a+b-c-d)
(a+b-c-d)
C.m=-![]() (c+a-d-b)
(c+a-d-b)
D.m=![]() (c+d-a-b)
(c+d-a-b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.SO2常用于纸张等植物纤维的漂白
B.工业上可用铝热反应大规模炼铁
C.光导纤维的主要成允是SiO2
D.电解熔融MgCl2 , 可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯催化氧化成乙醛可设计成如图所示的电化学装置,下列有关说法正确的是( )

A. 该电化学装置是电解池 B. a极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+
C. 氧气在b极被氧化 D. 电子移动方向:电极a→负载→电极b→磷酸溶液→电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1无色透明溶液中能大量共存的离子组是( )
A.Al3+、Ag+、NO3﹣、Cl﹣
B.Mg2+、NH4+、NO3﹣、Cl﹣
C.Ba2+、K+、S2﹣、Cl﹣
D.Cu2+、Na+、NO3﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物蒸气完全燃烧需三倍于其体积的氧气,产生于二倍于其体积的二氧化碳(体积均在相同状况下测定),该有机物可能是
A. C3H7OH B. CH3CHO C. CH3COCH3 D .C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。下列说法不正确的是( )

A.通入N2的电极发生的电极反应式为:N2+6e-+8H+=2NH4+
B.反应过程中溶液的pH会变大,故需要加入盐酸
C.该电池外电路电流从通入H2的电极流向通入N2的电极
D.通入H2的电极为负极,A为NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注。
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s) △H=-169kJ/mol
②C+1/2O2(g)=CO(g) △H=-110.5kJ/mol
③Cu(s)+1/2O2(g)=CuO(s) △H=-157kJ/mol
用炭粉在高温条件下还原CuO的方法制得纳米级Cu2O的热化学方程式为_______________。
(2)采用离子交换膜控制电解液中OH-的浓度也可以制备纳米级Cu2O,装置如图所示:
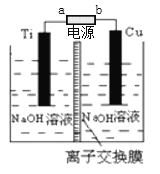
为保证电解能持续稳定进行,若电解槽中的离子交换膜只允许一种离子通过,则该交换膜应为_____ (填“Na+”或“H+”或“OH-”)离子交换膜,该电池的阳极反应式为_______。
(3)用Cu2O做催化剂,工业上在一定条件一下,可以用一氧化碳与氢气反应合成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)

①甲图是反反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=_________。
②乙图表示该反应进行过程中能量的变化。请在乙图中画出用Cu2O作催化剂时“反应过程——能量”示意图_________。
③温度升高,该反应的平衡常数K_____(填“增大”、“不变”或“减小”)。
④ 某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则该反应在该温度下的平衡常数为_____(保留一位有效数字)。相同温度下,若向上述2L密闭容器中加入4molCO、3molH2、1molCH3OH,反应开始时,v(正)____v(逆)(填“大于”、“小于”或“等于”)。
⑤ 在容积均为1L的a、b、c、d、e,5个密闭容器中都分别充入1molCO和2molH2的混合气体,控温。图丙表示5个密闭容器温度分别为T1~T5、反应均进行到5min时甲醇的体积分数,要使容器c中的甲醇体积分数减少,可采取的措施有___________。
⑥ 据研究,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是_______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是(填序号)______。
A.NaOH+HCl=NaCl+H2O B.Na2CO3+2HCl=2NaCl+H2O+CO2↑
C.2H2O=2H2↑+O2↑ D.Cu+2AgNO3=2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。有关实验现象,下列说法正确的是:_______(填序号)
A.图I和图II的气泡均产生在锌棒表面
B.图II中产生气体的速度比I快
C.图I中温度计的示数高于图II的示数
D.图I和图II中温度计的示数相等,且均高于室温

(3)大气污染越来越成为人们关注的问题.烟气中的NOx必须脱除(即脱硝)后才能排放。己知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=一890.3kJ·mol-l
N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-1
CH4可用于脱硝,写出该反应热化学反应式________。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
①电他的负极反应式为:__________。

②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池。试写出该电池的正极反应式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com