
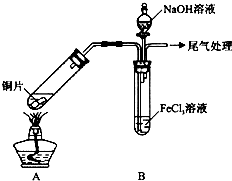
| 步骤② | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
分析 向FeCl3溶液中通人足量的SO2,再加入NaOH溶液,需先中溶液中的H+,在沉淀Fe2+,现象为开始没有明显现象,后有白色沉淀生成;结合电荷守恒和质量守恒,可以确定离子方程式:Fe3++H2O+Fe(HSO3)2+=2Fe2++SO42-+3H+;(5)均会发生反应生成Fe2+,加入K3[Fe(CN)6]生成蓝色的铁氰化亚铁;通过实验得出结论:加热或提高FeCl3溶液的酸性会缩短浅绿色出现的时间,
(1)制取气体的反应装置,制取之前应检查装置的气密性;二氧化硫尾气用NaOH溶液吸收;
(2)据配制一定物质的量浓度的溶液需要的仪器分析;
(3)FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,为FeCl2溶液,溶液显酸性;
(4)Fe(HSO3)2+离子可以将Fe3+还原为Fe2+,根据氧化还原反应特征书写离子方程式;
(5)铁氰化钾溶液与二价铁离子反应生成蓝色的Fe3(Fe(CN)6)2;
(6)综合上述实验分析,升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
解答 解:(1)制取气体的反应装置,制取之前应检查装置的气密性;二氧化硫尾气用NaOH溶液吸收,
故答案为:气密性;NaOH;
(2)配制100mL1mol/L FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100mL的容量瓶,
故答案为:胶头滴管、100mL的容量瓶;
(3)溶液显酸性,滴入NaOH溶液时,开始无现象,然后产生白色沉淀,
故答案为:开始无现象,然后产生白色沉淀;
(4)Fe(HSO3)2+离子可以将Fe3+还原为Fe2+,则由氧化还原反应有升必有降,则离子方程式为:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+;
故答案为:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+;
(5)铁氰化钾溶液与二价铁离子反应生成蓝色的Fe3(Fe(CN)6)2,所以所加试剂为铁氰化钾溶液K3[Fe(CN)6],
故答案为:K3[Fe(CN)6];
(6)综合上述实验分析,升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间,
故答案为:加热或提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
点评 本题为SO2的性质探究实验,涉及装置气密性的检验,尾气吸收,及物质的量浓度溶液的配制,题目难度中等.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{bc}{a{N}_{A}}$ | B. | $\frac{ac}{b{N}_{A}}$ | C. | $\frac{ab}{c{N}_{A}}$ | D. | $\frac{b}{ac{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液一定呈酸性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | c(OH-)═c(H+)的溶液一定呈中性 | |
| D. | 水中加入硫酸恢复至室温后,Kw=c(H+)•c(OH-)将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
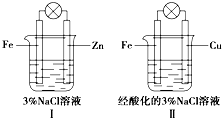
| A. | Ⅰ和Ⅱ中正极均被保护 | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-═Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-═4OH- | |
| D. | Ⅰ和Ⅱ中灯泡均会发亮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛应用.下图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.下图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:| 方案 | X | Y | a溶液 |
| A | 铜 | 石墨 | CuSO4 |
| B | 铜 | 铁 | CuSO4 |
| C | 铁 | 铜 | Fe(NO3)3 |
| D | 铁 | 铜 | CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验序号 | 1 | 2 | 3 |
| 滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
| 滴定终点读数(mL) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
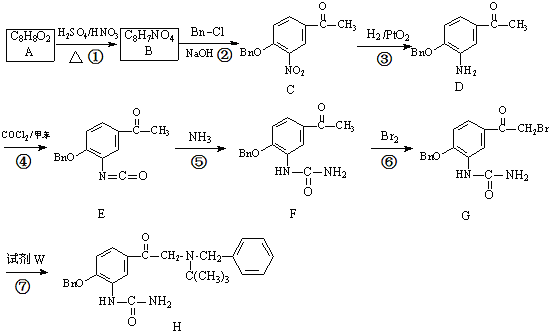
 试剂W
试剂W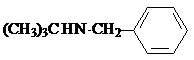 .
.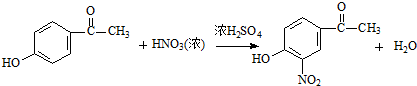 .
.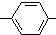 CH2
CH2 N=C=O生成高聚物的结构简式
N=C=O生成高聚物的结构简式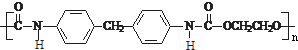 .
.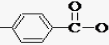 -CH2CH2N(C2H5)2(无机试剂任用)
-CH2CH2N(C2H5)2(无机试剂任用) 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物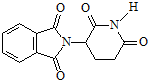 的分子式为C13H9O4N2 的分子式为C13H9O4N2 | |
| B. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH | |
| C. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| D. | 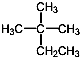 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | B. | I2+SO2+2H2O═H2SO4+2HI | ||
| C. | H2O2+H2SO4═SO2+O2↑+H2O | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com