
分析 (1)根据酸和碱的物质的量之比来判断;
(2)根据强碱弱酸盐,弱酸的酸根离子水解,溶液呈碱性来分析出;
(3)相同物质的量的酸和碱恰好中和,且中和后溶液显碱性,说明是醋酸与NaOH反应生成醋酸钠,醋酸根离子水解使溶液显碱性,据此分析离子浓度的大小.
解答 解:(1)某酸溶液物质的量为0.2mol/L×12.50mL,氢氧化钠溶液的物质的量25.00mL×0.1mol/L,酸和碱的物质的量之比1:1,所以酸为一元酸,不可能为硫酸,
故答案为:硫酸;
(2)醋酸与氢氧化钠反应生成醋酸钠,醋酸根离子水解:CH3COO-+H2O?CH3COOH+OH-,溶液呈碱性,
故答案为:醋酸;CH3COO-+H2O?CH3COOH+OH-;
(3)相同物质的量的酸和碱恰好中和,且中和后溶液显碱性,说明是醋酸与NaOH反应生成醋酸钠,醋酸根离子水解使溶液显碱性,则离子浓度大小顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
点评 本题主要考查了酸碱中和、盐类水解和溶液中离子浓度的比较,难度中等,根据所学知识即可完成.


科目:高中化学 来源: 题型:选择题
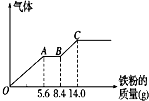 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )| A. | OA 段产生的是 NO,BC 段产生氢气,溶液中最终溶质为 FeSO4 | |
| B. | AB 段的反应为 Fe+2Fe3+═3Fe2+, | |
| C. | 原混合酸中NO3-物质的量为 0.3mol | |
| D. | H2SO4 浓度为 2.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH4++NH2-.
NH4++NH2-. NH3•H2O+H+.
NH3•H2O+H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 1mol | C. | 2mol | D. | 5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓氢氧化钠溶液中加入铝Al+2OH-═AlO2-+H2↑ | |
| B. | 氯化铝溶于水发生水解Al3++3H2O═Al(OH)3+3H+ | |
| C. | 明矾溶液中加入少量的氢氧化钡溶液Al3++3OH-═Al(OH)3↓ | |
| D. | 硫酸铝溶液中加入过量氢氧化钠溶液Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ②>①>④>③ | C. | ②>①>③>④ | D. | ④>③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com