
【题目】今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各200mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液无沉淀产生,加热后,收集到气体NH3 0.06mol;第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量变为4.66g。 根据上述实验,下列推测正确的是( )
A.一定存在K+和NH4+
B.200mL溶液中含0.02mol CO32-
C.Ba2+一定不存在,Mg2+可能存在
D.4.66g沉淀中含BaCO3和BaSO4
【答案】A
【解析】
根据题意分析,第一份溶液加入AgNO3溶液有沉淀产生,推得可能含有Cl-、CO32-、SO42-;第二份溶液加足量NaOH溶液无沉淀产生,说明不存在Mg2+,加热后收集到气体NH3,推得一定含有NH4+;第三份加足量BaCl2溶液后,有沉淀生成,经盐酸洗涤后,沉淀减少,说明溶液一定存在CO32-、SO42-,一定不存在Ba2+;根据阴阳离子的电荷守恒,结合题给数据计算判断K+、Cl-是否存在。
根据上述分析,溶液中一定不存在Mg2+、Ba2+,一定存在NH4+、CO32-、SO42-。第二份加足量NaOH溶液加热后,收集到气体NH30.06mol,说明含有0.06mol NH4+;第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤。干燥后,沉淀质量为4.66g。因此BaSO4为4.66g,物质的量为![]() ═0.02mol,说明含有0.02mol SO42-;BaCO3为12.54g-4.66g═7.88g,物质的量为
═0.02mol,说明含有0.02mol SO42-;BaCO3为12.54g-4.66g═7.88g,物质的量为![]() ═0.04mol,则CO32-物质的量为0.04mol;CO32-、SO42-所带负电荷分别为0.04mol×2、0.02mol×2,共0.12mol,NH4+所带正电荷为0.06mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.06mol,当K+物质的量>0.06mol时,溶液中还必须含有Cl-。
═0.04mol,则CO32-物质的量为0.04mol;CO32-、SO42-所带负电荷分别为0.04mol×2、0.02mol×2,共0.12mol,NH4+所带正电荷为0.06mol,根据溶液中电荷守恒,可知K+一定存在,K+物质的量≥0.06mol,当K+物质的量>0.06mol时,溶液中还必须含有Cl-。
A、上述分析可知一定含有K+和NH4+,故A正确;
B、由上述分析可得,200mL溶液中含有CO32-物质的量为0.04mol,故B错误;
C、溶液中一定存在CO32-、SO42-、NH4+,Ba2+和CO32-、SO42-,可发生离子反应生成BaCO3↓、BaSO4↓,因此Ba2+一定不存在。同时第二份加足量NaOH溶液加热后,收集到气体,没有产生沉淀,说明一定不含Mg2+,故C错误;
D、第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤。干燥后,沉淀质量为4.66g。部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,沉淀质量为4.66g为BaSO4,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】在一个体积为1 L的密闭容器中发生某化学反应:2A(g)![]() B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题:

(1)在实验Ⅰ中,反应在2040 min内A的平均反应速率为________mol L-1min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是____________。
(2)该反应的ΔH___________0,其判断理由是_____________。
(3)实验Ⅰ第40 min末,若降低反应温度,达到新的平衡后,A的浓度不可能为________(填序号)。
A.0.35 mol·L1 B.0.4 mol·L1 C.0.7 mol·L1 D.0.8 mol·L1
(4)若反应在800°C进行,在该1 L的密闭容器中加入1 mol A、0.2 mol He,达到平衡时A的转化率应____________。
A.等于86% B.等于50% C.小于50% D.在50%86%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
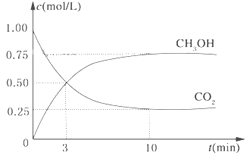
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(Lmin);
(2)氢气的转化率=______;
(3)该反应的平衡常数为______(保留小数点后2位);
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是______。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol H2
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1______c2的关系(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温下,相同浓度的溶液碱性比较:![]()
B.常温下,往![]() 溶液中滴加稀盐酸至中性时,溶质的主要成分有
溶液中滴加稀盐酸至中性时,溶质的主要成分有![]() 、
、![]()
C.加热![]() 溶液至蒸干,可得到纯净的
溶液至蒸干,可得到纯净的![]() 固体
固体
D.常温下,若![]() 溶液中含有
溶液中含有![]() 可用
可用![]() 溶液鉴别
溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. H2、I2、HI平衡混合气加压后颜色变深
C. 在合成氨的反应中,降温或加压有利于氨的合成
D. Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() 是一种有机光电材料中间体。实验室由芳香族化合物
是一种有机光电材料中间体。实验室由芳香族化合物![]() 制备
制备![]() 的一种合成路线如下:
的一种合成路线如下:
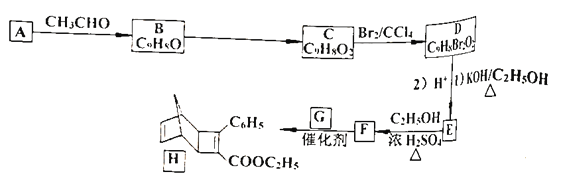
已知:①![]()
②![]() +
+![]()
![]()
![]()
回答下列问题:
(1)有机物![]() 的名称是__________。
的名称是__________。![]() 所含官能团的名称是__________。
所含官能团的名称是__________。
(2)已知②中物质“![]() ”的同系物丙烯是一种医疗卫生用布——聚丙烯无纺布的原材料,用化学符号表示丙烯的结构简式为__________。
”的同系物丙烯是一种医疗卫生用布——聚丙烯无纺布的原材料,用化学符号表示丙烯的结构简式为__________。
(3)![]() 能发生的反应类型分别是__________。
能发生的反应类型分别是__________。
a.聚合反应 b.加成反应 c.消去反应 d.取代反应
(4)![]() 的反应,若只把条件(1)改为
的反应,若只把条件(1)改为![]() ,则生成物
,则生成物![]() 的结构简式是__________。
的结构简式是__________。
(5)写出![]() 的化学方程式__________。
的化学方程式__________。
(6)![]() 为甲苯的同分异构体,
为甲苯的同分异构体,![]() 的结构简式是__________。
的结构简式是__________。
(7)参照如下合成路线,写出用![]() 和
和![]() 为原料经以上合成路线制备化合物
为原料经以上合成路线制备化合物![]() 的合成路线________(其它试剂任选)原料……
的合成路线________(其它试剂任选)原料……![]() 产物
产物
(8)芳香化合物![]() 是
是![]() 的同分异构体,
的同分异构体,![]() 能与饱和碳酸氢钠溶液反应放出
能与饱和碳酸氢钠溶液反应放出![]() ,苯环上的烃基为乙基,其核磁共振氢谱显示苯环上有4种不同化学环境的氢,峰面积比为1:1:1:1。写出一种符合要求的
,苯环上的烃基为乙基,其核磁共振氢谱显示苯环上有4种不同化学环境的氢,峰面积比为1:1:1:1。写出一种符合要求的![]() 的结构简式:__________ 。
的结构简式:__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22﹣存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )

A. 1 个 Ca2+周围距离最近且等距离的 C22﹣数目为 6
B. 该晶体中的阴离子与F2是等电子体
C. 6.4 g CaC2晶体中含阴离子0.1 mol
D. 与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是配制2mol/L氢氧化钠溶液250mL的操作过程,请按要求填空:
(1)所需固体氢氧化钠的质量为_____克。
(2)所需仪器除容量瓶(规格:____)、托盘天平、量筒、烧杯外,还需要的实验仪器有 ____,____。
(3)将称量好的氢氧化钠固体加入盛有约100 mL水的烧杯里,并不断搅拌,使其充分溶解。
(4)将冷却后的上述溶液沿玻璃棒注入______中,并用少量蒸馏水洗涤烧杯2~3次,洗涤液要转移至容量瓶中,并摇匀。
(5)加水至距刻度线___处,改用___加水,使溶液的凹液面正好跟刻度线相切。
(6)若定容时仰视凹液面,则最终所配得的溶液浓度_____(填偏大、偏小、无影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com