
(10分)把在空气中久置的铝片5.0 g投入盛有 500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如下的坐标曲线来表示,回答下列问题:
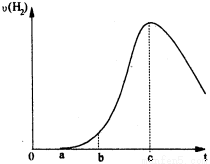
(1)曲线由0→a段不产生氢气的原因是 ,有关的化学方程式为 ;
(2)曲线由a→b段产生氢气的速率较慢的原因是: ;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因: ;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因: 。
(1)铝片表面被氧化成氧化铝,与硫酸反应不产生气体,Al2O3+3H2SO4=Al2(SO4)3+3H2O;
(2)体系温度较低;
(3)铝与硫酸反应放热,使溶液温度升高,反应速率加快;
(4)随反应进行,硫酸的浓度逐渐减小,反应速率减慢。
【解析】
试题分析:(1)曲线由0→a段不产生氢气的原因是铝片表面被氧化成氧化铝,首先是氧化铝与硫酸的反应,不产生气体,反应方程式是Al2O3+3H2SO4=Al2(SO4)3+3H2O;(2)曲线由a→b段产生氢气的速率较慢的原因是反应体系温度较低,温度降低,化学反应速率减小;(3)曲线由b→c段,产生氢气的速率增加较快的主要原因是铝与硫酸反应是放热反应,反应放出的热量使溶液温度升高,从而使反应速率加快;(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因是随反应进行,硫酸的浓度逐渐减小,浓度对速率的影响大于温度对速率的影响,所以反应速率减慢。
考点:考查硫酸与在空气中放置的金属铝反应速率的变化原因的分析的知识。


科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高二9月月考A层化学试卷(解析版) 题型:选择题
在下列溶液中,能大量共存的离子组是( )
A.能使pH试纸显蓝色的溶液中: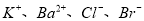
B.常温下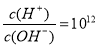 的溶液中:
的溶液中: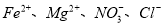
C.含有大量Al3+的溶液中: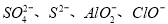
D.常温下pH为7的溶液中: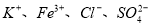
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高一9月月考化学试卷(解析版) 题型:选择题
质量相同的下列物质,含分子数最少的是
A.氢气 B.二氧化碳 C.氧气 D.氮气
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高一9月月考化学试卷(解析版) 题型:选择题
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是 ( )
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A.①和② B.①和③ C.③和④ D.①和④
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西四校9月联考高二化学试卷(解析版) 题型:选择题
已知2SO2(g)+O2(g) 2SO3(g) △H=-197kJ/mol。在25℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25℃时在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
2SO3(g) △H=-197kJ/mol。在25℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25℃时在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是( )
A.2a2=a1=197 kJ B.197 kJ> a1=2a2 C.a2>a1>197 kJ D.2a2<a1<197 kJ
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西四校9月联考高二化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
科目:高中化学 来源:2014秋贵州省遵义市高二上学期期中化学(文)试卷(解析版) 题型:选择题
用作食品袋的塑料应是无毒的,这种塑料袋的原料是
A.聚氯乙烯 B.聚乙烯 C.电木 D.尼龙
查看答案和解析>>
科目:高中化学 来源:2014秋福建省高二上学期期中化学(文)试卷(解析版) 题型:填空题
(10分)化学兴趣小组为探究某铁矿石(主要成分为Fe2O3和SiO2)的性质,进行如下实验:

(1)步骤(I)中分离溶液和沉淀的操作名称是 ;
(2)沉淀A中一定含有 ,该物质属于 (填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈 (填“黄色”或“红色”)
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com