
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有果香气味的烃的衍生物。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
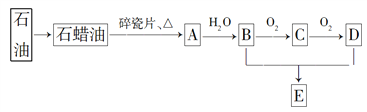
(已知乙醛在一定条件下可被氧化生成乙酸)
(1)丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基,则这种同分异构体的结构简式为________。
(2)B、D分子中官能团的名称分别是________、________,A→B的反应类型是________。
(3)写出反应A→B 、B→C的化学方程式:____________________________________。
【答案】 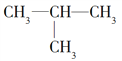 羟基 羧基 加成反应 CH2=CH2+H2O
羟基 羧基 加成反应 CH2=CH2+H2O![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,A是乙烯。乙烯与水发生加成反应生成B为乙醇,乙醇催化氧化生成C是乙醛,乙醛继续被氧化生成C是乙酸,乙醇与乙酸发生酯化反应生成E是乙酸乙酯,乙酸乙酯是具有果香气味的烃的衍生物。则
(1)丁烷的一种同分异构体中含有三个甲基,则这种同分异构体的结构简式为![]() 。(2)乙醇、乙酸分子中官能团的名称分别是羟基、羧基,A→B的反应类型是加成反应。(3)反应A→B的化学方程式为CH2=CH2+H2O
。(2)乙醇、乙酸分子中官能团的名称分别是羟基、羧基,A→B的反应类型是加成反应。(3)反应A→B的化学方程式为CH2=CH2+H2O![]() CH3CH2OH,B→C的化学方程式为2CH3CH2OH+O2
CH3CH2OH,B→C的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。


科目:高中化学 来源: 题型:
【题目】下列除杂方案正确的是( )
A.氢氧化钠溶液中混有氢氧化钡(硫酸铜溶液)
B.二氧化碳气体中混有氯化氢(氢氧化钠溶液)
C.硝酸铜溶液中混有硝酸银(铜粉)
D.氧化钙中混有碳酸钠(稀盐酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O
C. NaHSO4溶液与Ba(OH)2溶液混合后呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D. 二氧化锰和浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
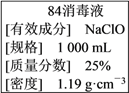
(1)消毒液”的物质的量浓度约为______ mol·L-1。
(2)某同学取100 mL 该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
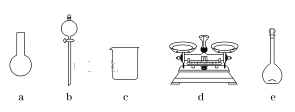
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除SO2、NOx对大气造成的污染具有重要现实意义。
(1)将一定量的空气样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下测得该试样的组成及其浓度如下表:
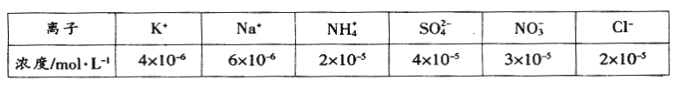
根据表中数据判断该试样的pH=____________。
(2)为减少SO2的排放,可将煤转化为清洁气体燃料,或将含SO2的烟气洗涤。
①已知:H2(g)+![]() O2(g)=H2O(g) △H=-241.8 kJ·mol-1
O2(g)=H2O(g) △H=-241.8 kJ·mol-1
C(s)+![]() O2(g)=CO(g) △H=-110.5 kJ·mol-1
O2(g)=CO(g) △H=-110.5 kJ·mol-1
写出焦炭与水蒸汽反应的热化学方程式____________。
②下列可作为洗涤含SO2烟气的洗涤剂是_________(填序号)。
A.浓氨水 B.碳酸氢钠饱和溶液
C.FeCl2饱和溶液 D.酸性CaCl2饱和溶液
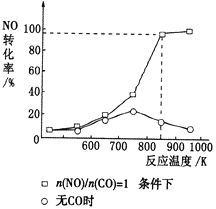
(3)实验室中研究有无CO对NO的有效消除程度,测得NO的转化率随温度的变化曲线如图所示。当无CO时,温度超过750K,发现NO的分解率降低,其可能的原因是________。当有CO且n(CO)/n(NO)=1时,为更好地除去NO,应控制的最佳温度为________K左右。
(4)用活性炭可处理大气污染物NO。在 5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
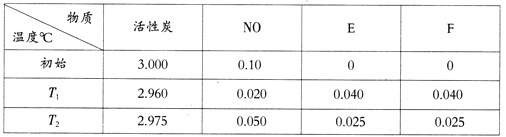
①写出NO与活性炭反应的化学方程式____________;
②若T1<T2,则该反应的△H________0(填“>”、“<”或“=”);
③上述反应T1℃时达到化学平衡后再通入0.1 mol NO气体,则达到新化学平衡时NO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO 4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6□+8H2O。下列说法不正确的是
A. 每转移1mole-,可以得到33g K2FeO4
B. □处的物质应为KCl
C. 该反应中铁元素的化合价升高
D. 氧化性:Cl2>K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分挟持装置已略去)进行实验:
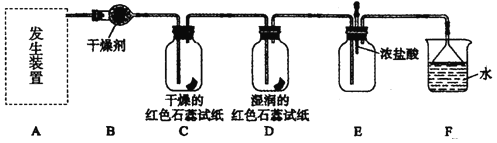
(1)写出实验室用固体制取氨气的化学方程式___________________________。
(2)利用上述原理,实验室制取氨气应选用下图中________发生装置进行实验。
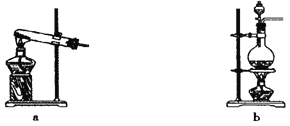
(3)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。
(4)气体通过C、D装置时,试纸颜色会发生变化的是________(填“C”或“D”),试纸颜色变为___________。
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,发生的化学反应是____________可观察到的现象是____________。
(6)F装置的作用是____________,装置中倒扣的漏斗是为了_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能。“金属(M)空气电池”(如下图)具有原料易得、能量密度高等优点。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。下列说法不正确的是
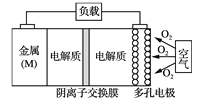
A. “金属(M)空气电池”放电过程的正极反应式: O2+2H2O+4e-=4OH-
B. 比较Mg、Al、Zn三种“金属—空气电池”,“Al—空气电池”的理论比能量最高
C. 电解质溶液中的阴离子从负极区移向正极区
D. 在“M—空气电池”中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述错误的是( )
A.酸性:HClO4>HBrO4B.稳定性:HF>HClC.碱性:KOH>NaOH>LiOH D.原子半径:S>Si
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com