
【题目】根据所学内容填空
(1)1mol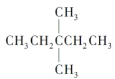 在氧气中充分燃烧,需要消耗氧气___________mol,它在光照的条件下与氯气反应,能生成_____种不同的一氯取代物。
在氧气中充分燃烧,需要消耗氧气___________mol,它在光照的条件下与氯气反应,能生成_____种不同的一氯取代物。
(2)现有三种有机物A.![]() B.CH3CH2CH2CH2CH3C.
B.CH3CH2CH2CH2CH3C.![]() ,其中A与B互称为__________________;B与C互称为___________________.
,其中A与B互称为__________________;B与C互称为___________________.
【答案】11 3种 同系物 同分异构体
【解析】
(1)根据烃燃烧的通式计算1mol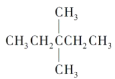 在氧气中充分燃烧消耗氧气的物质的量,用等效氢法判断一氯取代物的种类;
在氧气中充分燃烧消耗氧气的物质的量,用等效氢法判断一氯取代物的种类;
(2) ![]() 与CH3CH2CH2CH2CH3结构相似、分子组成相差2个CH2, CH3CH2CH2CH2CH3 与
与CH3CH2CH2CH2CH3结构相似、分子组成相差2个CH2, CH3CH2CH2CH2CH3 与![]() 分子式相同、结构不同;
分子式相同、结构不同;
(1)  的分子式是C7H16,燃烧方程式是
的分子式是C7H16,燃烧方程式是![]() ,1mol
,1mol 在氧气中充分燃烧消耗氧气的物质的量是11mol,
在氧气中充分燃烧消耗氧气的物质的量是11mol,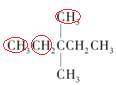 有3种等效氢原子,所以一氯取代物有3种;
有3种等效氢原子,所以一氯取代物有3种;
(2) ![]() 与CH3CH2CH2CH2CH3结构相似、分子组成相差2个CH2,A与B互称为同系物;CH3CH2CH2CH2CH3 与
与CH3CH2CH2CH2CH3结构相似、分子组成相差2个CH2,A与B互称为同系物;CH3CH2CH2CH2CH3 与![]() 分子式相同、结构不同,B与C互称同分异构体。
分子式相同、结构不同,B与C互称同分异构体。


科目:高中化学 来源: 题型:
【题目】金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是_____.
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是____.
(3)过滤金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=___.CO与N2结构相似,CO分子内σ键与π键个数之比为______.
(4)甲醛(H2C═O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为_____,甲醇分子内的O﹣C﹣H键角____(填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是
A. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
B. 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一原电池工作原理示意图,电池工作过程中左右两烧杯所盛放的溶液中不允许引入杂质。下列有关说法中正确的是( )

A.所用离子交换膜为阳离子交换膜
B.Cu电极的电极反应为Cu-2e-=Cu2+
C.电池工作过程中,CuCl2溶液浓度降低
D.Fe为负极,电极反应为Fe2++2e-=Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙是电化学实验装置,请回答下列问题:

(1)若甲、乙两个烧杯中均盛放饱和NaCl溶液。
①甲中石墨棒上的电极反应式是____________。
②将湿润的淀粉KI试纸放在乙烧杯的上方,发现试纸先变蓝后褪色,这是因为电解生成的某种气体A氧化了I-生成了I2。若A气体和I2按物质的量之比为5∶1反应,且生成两种酸,该反应的化学方程式为_________。
③如果不考虑气体产物与烧杯中溶液之间的反应,当乙反应有0.01 mol电子转移后停止实验,烧杯中溶液的体积为100 mL,则溶液混匀后的c(OH-)=_____。
(2)若甲、乙两烧杯中均盛放CuSO4溶液。
①甲中铁棒上的电极反应式为_______________。
②乙中总反应的离子方程式为_________________。
③如果起始时乙中盛放100 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的c(H+)=0.1mol/L,若要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入_____ (填写物质的化学式)______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气具有还原性,能够被氧化铜氧化,用如图中的装置可以实现该反应。

已知:氨可以与灼热的氧化铜反应得到氮气和金属铜。回答下列问题:
(1)B中加入的干燥剂是____(填序号)。
①浓硫酸 ②无水氯化钙 ③碱石灰
(2)能证明氨与氧化铜反应的现象是C中________。
(3)D中有无色液体生成。设计实验检验D中无色液体的成分:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6﹣n]m,该物质广泛应用于日常生活用水和工业废水的处理。该物质可溶于盐酸产生相应的金属阳离子。为检测PAFC中铝和铁元素的含量,采用如图所示流程进行:
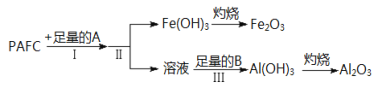
回答下列问题:
⑴PAFC中铁元素的化合价为_____,如何检验该元素的存在___________________
⑵步骤I中的试剂A是_______________(从“氢氧化钠溶液”、“氨水”中选择)步骤Ⅲ中的试剂B是_____________,离子方程式是__________
⑶步骤Ⅱ的操作是______________________
Ⅱ. ⑴甲同学用氢氧化钠溶液和氯化亚铁溶液制备氢氧化亚铁沉淀,该同学将氢氧化钠溶液加入氯化亚铁溶液中,观察到的现象是____________,反应过程中发生反应的化学方程式是_________。乙同学通过如下改进制备氢氧化亚铁:
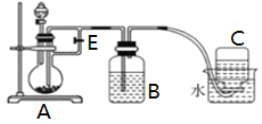
实验提供的试剂:铁屑、3mol/L硫酸溶液、NaOH溶液。请回答下列问题:
⑵①分液漏斗中盛装的试剂是______________溶液 (从“H2SO4”和“NaOH”中选择)。
②实验开始时应将止水夹E___________ (从“打开”和“关闭”中选择)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如右图所示位置(两侧温度相同)。则混合气体中CO和CO2的分子个数比为 ( )

A.1:1 B.1:3 C.2:1 D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学原理在工业上的应用,说法正确的是
A.合成NH3时高温和实验室制取NH3加热的原理一样
B.甲烷、乙烯、苯和酯都可通过石油分馏得到
C.电解饱和氯化钠溶液可以制取金属钠
D.可通过反应C+H2O![]() CO+H2制水煤气
CO+H2制水煤气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com