
【题目】BaTiO3、KH2PO4和NaNO2都属于铁电体,它们具有许多特异的性能如当它受压力而改变形状时产生电流,通电时会改变形状等。
(1)基态Ti原子的价电子排布式为___________,属于___________区元素。
(2)KH2PO4晶体中存在的作用力有___________(选填字母)。
A.离子键 B.共价键 C.氢键
(3)NO2-中N原子的杂化类型为___________,键角(填“>、<或=”)___________120°,其原因是___________。N、O、Na三种元素的第二电离能(I2)由大到小的顺序为___________(用元素符号表示)。
(4)BaTiO3的晶胞如下图所示:

Ti原子的配位数为___________,晶体的密度为ρg/cm3,最近的Ba原子和O原子之间的距离为___________(填计算式)nm。( BaTiO3的摩尔质量为233g/mol,NA为阿伏加德罗常数的值)
【答案】3d24s2 d ABC sp2 < N原子上有一对孤对电子,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力 Na>O>N 6 ![]()
【解析】
(1) Ti是22号元素,根据原子构造原理可得其核外电子排布式,得到基态Ti原子的价电子排布式,并根据元素原子结构与元素在周期表的位置关系判断其所属区域;
(2)KH2PO4是盐,属于离子晶体,含离子键,在阴离子H2PO4-中含有P-O键、O-H键,-OH与其它的-OH间可形成氢键;
(3)根据N、O原子间形成的电子对分析原子杂化,并结合孤电子对与成键电子对之间的作用力情况判断键角大小;
(4)从元素的+1价离子的稳定性大小分析I2大小;
(5)根据晶胞在各种微粒的空间构型及相对位置判断Ti的配位体数目;用均摊法计算一个晶胞中含有的各种元素的原子个数,计算晶胞的质量,利用m=ρV、及边长V= L3计算晶胞边长,最后根据Ba与O原子的位置在面对角线的一半就可计算出两个微粒间的距离。
(1)Ti是22号元素,根据原子构造原理可得其核外电子排布式为1s22s22p63s23p63d24s2,所以基态Ti原子的价电子排布式是3d24s2,Ti位于元素周期表第四周期第IVB族,属于d区;
(2) KH2PO4是盐,属于离子晶体,含离子键,在阴离子H2PO4-中含有P-O键、O-H键,-OH中的O原子与其它KH2PO4之间-OH的H原子间可形成氢键,故合理选项是ABC;
(3)在NO2-中存在N=O和N-O,所有NO2-中的N原子采用sp2杂化,N原子最外层有5个电子,其中一对为孤电子对,有3个成键电子,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力,所以键角小于120°;
(4) 由于Na+是最外层8个电子的稳定结构,气态基态Na+从8电子稳定结构再失去一个电子最难,气态基态O+从2p3半充满较稳定结构再失去一个电子较难。所以Na+ 的第二电离能I2最大,N+最小,因此三种元素的第二电离能(I2)由大到小的顺序为Na>O>N;
(5)根据晶胞结构示意图可知:Ti位于晶胞中心,O原子位于晶胞六个面心上,Ba位于晶体的8个顶点上,所以Ti的配位体数目是6;在一个晶胞中含有的各种元素的原子个数Ti:1×1=1;Ba:![]() ×8=1,O:
×8=1,O:![]() ×6=3,即一个晶胞中含有1个BaTiO3,其质量m=
×6=3,即一个晶胞中含有1个BaTiO3,其质量m=![]() g,由于晶胞的密度是ρg/cm3,所以晶胞的体积V=
g,由于晶胞的密度是ρg/cm3,所以晶胞的体积V=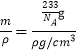 =
=![]() cm3,则晶胞的边长L=
cm3,则晶胞的边长L=![]() cm=
cm=![]() ×10-7nm,最近的Ba原子和O原子位于面对角线的一半位置,所以最近的Ba原子和O原子之间的距离为a=
×10-7nm,最近的Ba原子和O原子位于面对角线的一半位置,所以最近的Ba原子和O原子之间的距离为a=![]() L=
L=![]() nm。
nm。


科目:高中化学 来源: 题型:
【题目】金属铼熔点高、耐磨、耐腐蚀,广泛用于航天航空等领域。工业上用富铼渣(含ReS2)制得铼粉,其工艺流程如下图所示:

回答下列问题
(1)下图是矿样粒度与浸出率关系图,浸出时应将富铼渣粉碎至___________目;请给出提高铼浸出率的另外两种方法:___________。浸出反应中ReS2转化为两种强酸,请写出铼浸出反应的离子方程式:______________________。

(2)上图表示萃取液流速与铼吸附率关系。结合实际工业生产效益,萃取剂流速宜选用的范围是___________BV/h。
(3)已知高铼酸铵不溶于冷水,易溶于热水。提纯粗高铼酸铵固体的方法是___________。
(4)高铼酸铵热分解得到Re2O7,写出氢气在800℃时还原Re2O7制得铼粉的化学方程式______________________。
(5)整个工艺流程中可循环利用的物质有:H2SO4、___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的正确判断是( )
A. 在pH=12的溶液中,K+、Cl﹣、HCO3﹣、Na+可以大量共存
B. 在pH=0的溶液中,Na+、NO3﹣、SO32﹣、K+可以大量共存
C. 由0.1molL﹣1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH﹣
D. 由0.1molL﹣1一元酸HA溶液的pH=3,可推知NaA溶液存在A﹣+H2OHA+OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种X溶液,均能跟盐酸反应,其中反应最快的是( )
A. 10 ℃ 3 mol·L-1的X溶液
B. 20 ℃ 3 mol·L-1的X溶液
C. 10 ℃ 2 mol·L-1的X溶液
D. 20 ℃ 2 mol·L-1的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
C.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
D.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比c(B)/c(C) 将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质, A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色________。(填“变浅”“变深”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验测得,5 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式:_________________________________________。
(2)下图为N2(g)和O2(g)生成NO (g)过程中的能量变化:

则N≡N键的键能为________kJ·mol-1。根据上图写出N2(g)和O2(g)生成NO(g)的热化学方程式:_____________________________________________________________
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知: C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1③
根据盖斯定律,计算298 K时由C(石墨,s)和H2(g)生成1 mol C2H2(g)反应的焓变:________________________________________________________________________。
(4)接触法制硫酸工艺中,其主反应在450 ℃并有催化剂存在下进行:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-190 kJ·mol-1。
2SO3(g) ΔH=-190 kJ·mol-1。
①该热化学反应方程式的意义是___________________________________________________
②已知单质硫16 g燃烧放热为149 kJ,写出硫燃烧热的热化学方程式:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2 min后,B的浓度减少了0.6mol/L。下列反应速率的表示正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 用C表示的反应速率是0.2 mol/(L·min)
C. 2 min末时的反应速率,用B表示是0.3 mol/(L·min)
D. 在这2 min内用B表示的反应速率的值是减小的,C表示的反应速率逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g) + 3B(g) ![]() 2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:①v(A)=0.45mol·L—1·min—1 ② v(B)=0.6mol·L-1·s-1 ③v(C)=0.4mol·L-1·s-1 ④v(D) =0.45mol·mol·L—1·min—1,该反应进行的快慢顺序为
2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:①v(A)=0.45mol·L—1·min—1 ② v(B)=0.6mol·L-1·s-1 ③v(C)=0.4mol·L-1·s-1 ④v(D) =0.45mol·mol·L—1·min—1,该反应进行的快慢顺序为
A. ①>③=②>④ B. ①>②=③>④
C. ②>①=④>③ D. ④>②=③>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com