
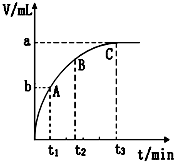
 某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:分析 (1)根据反应中浓度的变化写出化学方程式;
(2)根据2min内X浓度的变化计算得出;
(3)根据增加固体或者纯液态,反应速率不变分析;
(4)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:(1)根据图象可知Y、Z浓度降低,为反应物,X浓度增大为生成物,当物质的量不再变化时,达到平衡状态,此时△n(Y)=1.2mol-1.0mol=0.2mol,△n(Z)=2.0mol-1.6mol=0.4mol,△n(X)=1.0mol-0.4mol=0.6mol,计量数之比等于△n(Y):△n(Z):△n(X)=1:2:3,化学方程式可写为Y+2Z?3X,
故答案为:Y+2Z?3X;
(2)反应开始至2min末,△n(X)=0.8mol-0.4mol=0.4mol,△c(X)=$\frac{0.4mol}{3L}$=$\frac{2}{15}$mol/L,化学反应速率为$\frac{\frac{2}{15}}{2}$=0.067mol/(L•min),
故答案为:0.067mol/(L•min);
(3)增加Y的用量,化学反应速率不变化,说明Y为固体或纯液体,故答案为:固体或纯液体;
(4)①生成1mol X的同时,消耗2mol Y,都是指正反应方向,所以不能判断达到平衡状态,故错误;
②反应前后气体的质量不变,气体物质的量之和也不变,所以混合气体的平均摩尔质量一直不变,所以不能判断达到平衡状态,故错误;
③容器中各组分浓度不再变化,正逆反应速率相等,达到了平衡状态,故正确;
④混合气体中Z、Y、X三者浓度之比等于三者的化学计量数之比,无法确定正逆反应速率相等,所以不能判断达到平衡状态,故错误;
故选:③.
点评 本题考查化学平衡的变化图象以及平衡状态的判断,题目难度不大,本题注意化学方程式的确定方法,以及反应速率计算,把握好相关概念和公式的理解及运用.


科目:高中化学 来源: 题型:选择题
| A. | 6+m | B. | 6-m | C. | 3+m | D. | 3-m |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA | |
| B. | 0.1mol Na2SO4溶液中,含有SO42-数为0.1NA | |
| C. | 46gNO2和N2O4混合气体中,含有氧原子总数为3NA | |
| D. | 0.5L 1mol/LNaCl溶液中含有的钠离子浓度1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
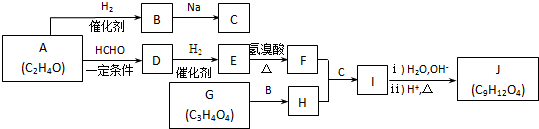
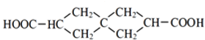 .J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.符合上述条件的X有2种,写出其中一种的结构简式
.J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.符合上述条件的X有2种,写出其中一种的结构简式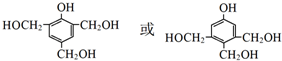 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

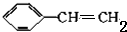 .
.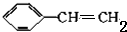 +HBr$\stackrel{一定条件下}{→}$
+HBr$\stackrel{一定条件下}{→}$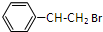 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组对H2O2的分解速率做了如下实验探究.
某课外兴趣小组对H2O2的分解速率做了如下实验探究.| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题: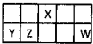
 .
.| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制金属钠:电解饱和食盐水 | |
| B. | 工业制溴:某些植物有富集溴的能力,从海产品中提取溴是工业上获取溴的重要途径 | |
| C. | 冶炼铝:电解Al2O3,同时加入冰晶石(Na3AlF6),目的是为了降低Al2O3熔融温度 | |
| D. | 硫酸工业:在氧气充足的情况下,从接触室进入吸收塔的气体中不可能含有SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com