
| A. | 固体分解越完全,消耗盐酸的量越少 | |
| B. | 共生成0.1mol二氧化碳,固体中氯化钠为5.85g | |
| C. | 固体中碳酸氢钠含量越多,钠元素的含量也越多 | |
| D. | 溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g |
分析 根据物质的性质碳酸氢钠受热分解(2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑),再加入足量盐酸发生的反应可能有NaHCO3+HCl═NaCl+H2O+CO2↑,Na2CO3+2HCl═2NaCl+H2O+CO2↑,据此进行解题分析.
解答 解:A.固体分解不完全的话固体有NaHCO3和Na2CO3,根据方程式NaHCO3+HCl═NaCl+H2O+CO2↑,则1molNaHCO3消耗1molHCl,由Na2CO3+2HCl═2NaCl+H2O+CO2↑,则1molNa2CO3消耗2molHCl,则相同的物质的量的条件下Na2CO3消耗的盐酸多,故固体完全分解都变成Na2CO3,消耗盐酸的量增加,故A错误;
B.根据碳原子守恒得:n(NaHCO3)=n(CO2)=0.1mol,m(NaHCO3)=n(NaHCO3)M=0.1×84=8.4g,m(NaCl)=8.985-8.4=0.585g,故B错误;
C.极限思想,假设8.985g都是NaHCO3钠元素的含量为$\frac{23}{84}$×100%=27.4%,8.985g都是NaCl钠元素的含量$\frac{23}{58.5}$×100%=39.3%,故NaCl越多钠元素的含量越高,故C错误;
D.溶液中的钠离子来自NaHCO3,NaCl,设有xmolNaHCO3,ymolNaCl.根据钠原子守恒得,n(NaHCO3)+n(NaCl)=0.11即x+y=0.11①84x+58.5y=8.985②,联立①②解得,x=0.1,y=0.01,m(NaHCO3)=0.1×84=8.4g,故D正确;
故选D.
点评 本题考查化学反应的计算,了解物质的性质碳酸氢钠受热分解,氯化钠受热不分解,并能正确的书写化学方程式也是解题的关键.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 饱和机物中碳原子不能发生化学反应 | |
| B. | C原子只能与C原子形成不饱和键 | |
| C. | 任何有机物中H原子数目不可能为奇数 | |
| D. | 五个C原子之间能够形成五个碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
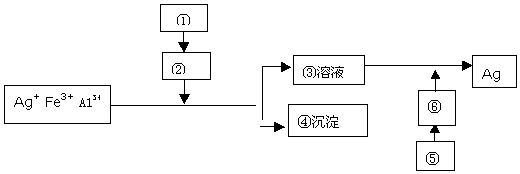
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  互为同分异构体 互为同分异构体 | |
| B. |  与 与 两种烃互为同系物 两种烃互为同系物 | |
| C. | 甲苯与溴蒸汽的反应产物受反应条件的影响而不同 | |
| D. | H2和D2互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3a}{2}$ mol | B. | $\frac{a}{18}$ mol | C. | $\frac{a}{27}$ mol | D. | $\frac{a}{96}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.015 | B. | 0.225 | C. | 0.035 | D. | 0.045 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com