
生活中的一些问题常涉及到化学知识,则下列叙述正确的是
A.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
B.明矾和漂白粉常用于自来水的处理,两者的作用原理相同
C.氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应
D.向硅酸钠溶液中加入盐酸产生白色沉淀,过量时沉淀溶解
科目:高中化学 来源:2016届浙江省嘉兴市高三上学期期中测试化学试卷(解析版) 题型:实验题
络氨铜【[Cu(NH3)4]SO4】是一种重要的染料及农药中间体。已知:①以氧化铜为主要原料合成该物质的合成路线如下图:
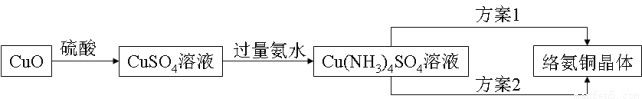
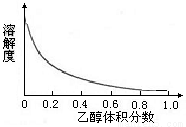
②络氨铜在乙醇-水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下。
③(NH4)2SO4在水中可溶,在乙醇中难溶。
请根据以上信息回答下列问题:
(1)由CuO制出的CuSO4溶液中常含有 Fe2(SO4)3杂质,请设计一个可行方案,检验CuSO4溶液中是否含有Fe3+: 。
(2)[Cu(NH3)4]SO4 在水中存在如下解离过程:[Cu(NH3)4]SO4===[Cu(NH3)4]2+(深蓝色离子)+SO42-;[Cu(NH3)4]2+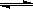 Cu2++4NH3。请写出在CuSO4溶液中逐滴加入氨水至过量的反应现象: 。
Cu2++4NH3。请写出在CuSO4溶液中逐滴加入氨水至过量的反应现象: 。
(3)①方案1的实验步骤为:加热蒸发→冷却结晶→过滤洗涤→干燥。该方案存在明显缺陷,因为得到的产物晶体往往含有Cu2(OH)2SO4杂质,产生该杂质的原因是 。
②方案2是较为理想的结晶方案,先向溶液C加入适量 (填物质名称),再过滤、洗涤、干燥即可得到较纯净的晶体。下列选项中,最适合作为滤出晶体洗涤液的是 。
A.乙醇 B. 蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤沉淀的操作方法是 。
(4)氨含量的测定:准确称取a g络氨铜样品,加入过量NaOH溶液微热,使NH3充分释放,并被准确量取的30.00mL 0.5000mol.L-1HCl溶液充分吸收。吸收液用0.1200mol·L-1的NaOH溶液滴定,消耗的NaOH溶液的体积为V L,则络氨铜样品中氨的质量分数为 (用含a、V的字母表达)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上学期期中测试化学试卷(解析版) 题型:选择题
根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是
①Cl2+2KI═I2+2KCl
②2FeCl3+2HI═I2+2FeCl2+2HCl
③2FeCl2+Cl2═2FeCl3
④I2+SO2+2H2O═2HI+H2SO4.
A.Cl2>I2>Fe3+>SO2
B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>I2>SO2
D.Cl2>Fe3+>SO2>I2
查看答案和解析>>
科目:高中化学 来源:2016届北京市高三上学期期中测试化学试卷(解析版) 题型:选择题
通常海水的pH=8.1,在稳定海水pH中起作用的离子是
A.Na+ B.HCO3- C.CO32- D.Cl-
查看答案和解析>>
科目:高中化学 来源:2016届宁夏长庆高级中学高三上学期第三次月考理综化学试卷(解析版) 题型:填空题
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
阳离子 | K+ | Cu2+ | Fe3+ | Al3+ | Fe2+ |
阴离子 | Cl- | CO32- | NO | SO42- | SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是 。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式__________。
(4)甲同学最终确定原溶液中所含阳离子是________,阴离子是________(写离子符号)。
(5)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为________g。
查看答案和解析>>
科目:高中化学 来源:2016届四川省绵阳市高三上学期第一次诊断性测试理综化学试卷(解析版) 题型:选择题
七种短周期元素在元素周期表中的相对位置如表所示。其中B的最高价氧化物的水化物能与B的气态氢化物反应生成离子化合物,下列说法正确的是

A.氧化物对应的水化物的酸性:G一定强于F
B.简单离子的半径:F>G>C>D
C.1 mol EC2中含2 mol E-C键
D.A、G分别与氢元素形成的化合物中,化学键均为极性共价键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省龙海市高二上学期期中测试化学试卷(解析版) 题型:选择题
右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和稀盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是

A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e-=Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一上学期期中测试化学试卷(解析版) 题型:选择题
某溶液可能含有Na+ 、Ag+、Al3+、S2-、CO32-、SO32-、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色。根据以上实验现象,下列关于原溶液中离子成分的推测正确的是
A.一定有S2-、SO32-、Na+
B.可能只有Na+、S2-、CO32-
C.一定没有Ag+、Al3+
D.可能只有Na+、S2-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江台州中学高二上第三次统练化学试卷(解析版) 题型:选择题
在同温同压下,下列各组热化学方程式中△H1>△H2的是
A.2H2(g)+O2(g)=2H2O(l) ;△H1; 2H2(g)+O2(g)=2H2O(g);△H2
;△H1; 2H2(g)+O2(g)=2H2O(g);△H2
B.S(g)+O2(g)=SO2(g);△H1; S(s)+O2(g)=SO2(g);△H2
C.C(s)+1/2O2(g)=CO(g);△H1; C(s)+O2(g)=CO2(g);△H2
D.H2(g)+Cl2(g)=2HCl(g);△H1; 1/2H2(g)+1/2Cl2(g)=HCl(g);△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com