
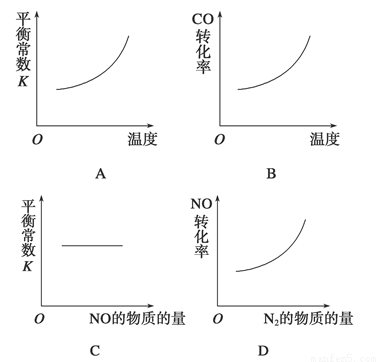
汽车尾气净化中的一个反应如下:
NO(g)+CO(g) 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:2014高考名师推荐化学周期表、核素(解析版) 题型:选择题
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
A 体积相等时密度相等
B 原子数相等时具有的中子数相等
C 体积相等时具有的电子数相等
D 质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学键与分之间作用力(解析版) 题型:选择题
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的阴离子核外电子排布与氦原子相同,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法中正确的是
A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
B.化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键
C.用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀
D.X、Z两元素能形成原子个数比为3∶1和4∶2的化合物
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡的标志(解析版) 题型:选择题
在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)  ?C(g)+D(g)已达到平衡状态
?C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A.①②③④⑤⑥⑦⑧ B.①③④⑤
C.①②③④⑤⑦ D.①③④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数(解析版) 题型:选择题
已知反应①CO(g)+CuO(s)  CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
A.反应①的平衡常数
B.反应③的平衡常K=
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数、等效平衡(解析版) 题型:填空题
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
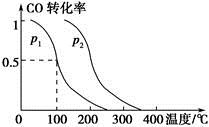
①p1________p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”,下同),平衡常数________。
(3)已知在T ℃时,CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
此时刻v正________v逆(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数、等效平衡(解析版) 题型:选择题
在一恒定的容器中充入2molA和1molB发生反应:2A(g)+ B(g) xC(g),达到平衡后,C的体积分数为ω%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为ω%,则x值为
xC(g),达到平衡后,C的体积分数为ω%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为ω%,则x值为
A、只能为2 B、只能为3
C、可能是2,也可能是3 D、无法确定
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡图像的分析(解析版) 题型:选择题
NO2和N2O4可相互转化:2NO2(g)  N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是
N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是
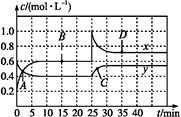
A.图中共有两条曲线x和y,其中曲线y表示NO2浓度随时间的变化
B.A、B、C、D四个点中,表示化学反应处于平衡状态的点是B和C
C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4
D.若要达到与D相同的状态,在25 min时还可采取的措施是适当缩小容器体积
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期律及化学键(解析版) 题型:填空题
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之______________。(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能”)发生反应产生H2,判断理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com