
A.2 mL B.4 mL C.8 mL D.无法计算
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
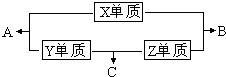 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
| ||
| △ |
| ||
| △ |
| 加热 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源:湖北省天门中学2008-2009学年高二下学期5月月考化学试题(A卷) 题型:013
|
在常温常压下,将16 mL H2、CH4、C2H2的混合气体与足量的O2混合,点燃后使之完全燃烧,冷却至原状态,测得总体积比原体积减小26 mL,则混合气体中CH4的体积是 | |
| [ ] | |
A. |
2 mL |
B. |
4 mL |
C. |
8 mL |
D. |
无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温常压下,将16 mL H2、CH4、C2H2的混合气体与足量的O2混合,点燃后使之完全燃烧。冷却至原状态,测得总体积比原体积减小26 mL,则混合气体中CH4的体积是( )
A.2 mL B.4 mL C.8 mL D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com