


科目:高中化学 来源: 题型:
| 硫酸铜溶液 | ① | ② | ③ | ④ |
| 加入的无水硫酸铜(g) | 3.0 | 5.5 | 8.5 | 10.0 |
| 析出的硫酸铜晶体(g) | 1.0 | 5.5 | 10.9 | 13.6 |
| A、7.7 | B、6.8 |
| C、5.8 | D、9.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
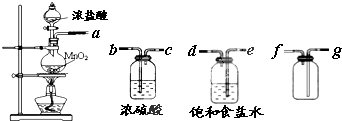
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 | 固体物质中有FeCl3 | |
| 向a溶液中滴加 酸性KMnO4溶液 | KMnO4溶液紫色 不褪色 | 固体物质中不含 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 序号 | 实验操作 | 预期现象 | 结论 |
| Ⅰ | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,然后滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 样品含NaCl | |
| Ⅱ | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解, | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2是氧化剂,反应中Cl原子得到电子 |
| B、当1molCl2完全反应时,有2mol电子发生转移 |
| C、NaBr是还原剂,反应中溴离子得到电子 |
| D、当1molNaBr完全反应时,有1mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 台湾的食品中“塑化剂”是一种塑料中的添加剂,不是食品添加剂,会危害男性生殖能力,促使女性性早熟,会伤害人类基因.因此不能用于食品当中,而且用了增塑剂的包装材料或者容器不能用于包装脂肪性的食品.有关说法正确的是( )
台湾的食品中“塑化剂”是一种塑料中的添加剂,不是食品添加剂,会危害男性生殖能力,促使女性性早熟,会伤害人类基因.因此不能用于食品当中,而且用了增塑剂的包装材料或者容器不能用于包装脂肪性的食品.有关说法正确的是( )| A、“塑化剂”能溶于水 |
| B、“塑化剂”是邻苯二甲酸酯,它水解可以生成邻苯二甲酸和醇 |
| C、该物质为高分子化合物 |
| D、应推广使用聚氯乙烯塑料袋包装食品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com