
【题目】下列关系式中,正确的是
A. 等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO- )+c(OH-)=c(H+)+c(CH3COOH)
B. 常温下,0.1 mol·L-1HA溶液与0.1 mol·L NaOH溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH )=c(H+)
C. 常温下,0.1 mol·L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
D. 常温下,将0.1 mol·L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CHCOO-)/c(CHCOOH)的值增大到原来的100倍
【答案】D
【解析】
试题A、混合液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒关系为:2c(Na+)=c(CH3COOH)+c(CH3COO-),根据以上两个关系可得:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-),错误;B、混合溶液中溶质为NaA,如果HA是强酸,溶液呈中性,如果HA是弱酸,溶液呈碱性,所以溶液中c(OH-)≥c(H+),错误;C、根据硫化钠溶液中的质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;D、醋酸的电离平衡常数为:K=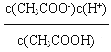 ,所以:
,所以:![]() =
=![]() ,由于稀释前后温度相同,则醋酸的电离平衡常数K不变,
,由于稀释前后温度相同,则醋酸的电离平衡常数K不变,![]() 与氢离子浓度成反比,当溶液的pH从3.0升到4.0时,溶液中氢离子浓度缩小为原先的
与氢离子浓度成反比,当溶液的pH从3.0升到4.0时,溶液中氢离子浓度缩小为原先的![]() ,则
,则![]() 的值增大到原来的100倍,正确。
的值增大到原来的100倍,正确。


科目:高中化学 来源: 题型:
【题目】温度和压强相同时,在体积相同的两个密闭容器甲和乙,甲中充满O2气体,乙中充满O2和O3的混合气体,下列说法正确的是
A. 两容器中气体的质量相等 B. 两容器中气体的分子数目相等
C. 两容器中气体的氧原子数目相等 D. 两容器中气体的密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一套制取并验证氯气部分化学性质的实验装置。已知:Cl2+2KI=I2+2KCl。

回答下列问题:
(1)装置A中,仪器a的名称叫____,该仪器中盛放的试剂为_____。
(2)装置B的作用是___,当氯气通过一段时间后,B中溶液的pH___7(填“>”“<”或“=”)。
(3)当有少量Cl2通过后,观察到装置C中溶液变成____色。
(4)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?为什么_____。
(5)若要证明Cl2无漂白性,则必须在装置D之前加一个装有____的洗气瓶。
(6)装置E的作用是___,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g) + O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | t1 | t2 | t3 | t4 |
n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是
A.反应在前t1s 的平均速率v(O2) = 0.4/t1mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g14.0%的NaCl溶液跟30.0g24.0%的NaCl溶液混合,得到密度为1.15g/cm3的混合溶液。求:
(1)该混合溶液的质量分数为_________?
(2)该混合溶液的物质的量浓度为_________?
(3)在1000g水中溶解_______摩尔NaCl才能使其浓度与上述溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图甲所示(空气中N2与O2的物质的量之比按4:1计)。上述过程中,膜I侧所得气体的物质的量之比n(H2):n(N2)=3:1,则CH4、H2O与O2反应的化学方程式为______________________。

(2)用H2和CO合成甲醇的热化学方程式为CO(g)+2H2(g) ![]() CH3OH (g) △H1。已知:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1;CO(g)+H2O(g)==CO2(g)+H2(g) △H3=-41.1k J·mol-1.则△H1=___________ k J·mol-1。
CH3OH (g) △H1。已知:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1;CO(g)+H2O(g)==CO2(g)+H2(g) △H3=-41.1k J·mol-1.则△H1=___________ k J·mol-1。
(3)向容积可变的密闭容器中充入1 mol CO和2.2molH2,在恒温恒压条件下发生反应CO(g)+2H2(g)![]() CH3OH(g),平衡时,CO的转化率[α(CO)]随温度、压强的变化情况如图乙所示。
CH3OH(g),平衡时,CO的转化率[α(CO)]随温度、压强的变化情况如图乙所示。

①压强:p1___________(填“>”<”或“=”)p2。
②M点时,H2的转化率为___________(计算结果精确到0.1%),该反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③不同温度下,该反应的平衡常数的对数值(lgK)如图丙所示,其中,A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是___________。
(4)H2还原NO的反应为2NO(g)+2H2(g)![]() N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(H2)/(mol/L) | c(NO)/(mol/L) | v/(mol/Lmin) |
1 | 0.10 | 0.10 | 0.414k |
2 | 0.10 | 0.20 | 1.656k |
3 | 0.50 | 0.10 | 2.070k |
由表中数据可知,m=___________,n=___________。
②上述反应分两步进行:i.2NO(g)+H2(g)==N2(g)+H2O2(1)(慢反应);ii.H2O2(1)+H2(g)==2H2O(1)(快反应)。下列叙述正确的是___________(填字母)
A.H2O2是该反应的催化剂
B.反应i的活化能较高
C.总反应速率由反应ii的速率决定
D.反应i中NO和H2的碰撞仅部分有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产含氯有机物时会产生HCl,利用如下反应可实现氯的循环利用。4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)+Q(Q>0)在2L密闭容器中进行该反应,在不同时间测得实验数据如下表:
物质 物质的量 (mol) 时间 | HCl(g) | O2(g) | H2O(g) | Cl2(g) |
0min | 4 | 1 | 0 | 0 |
2min | 1.2 | 0.3 | 1.4 | |
3min | 1.2 | 0.3 | 1.4 | |
4min | 1.0 | 0.35 | 1.5 |
(1)计算0~2min内Cl2的平均生成速率___________________。 该反应合适的温度范围是380~440℃,选择该温度范围可能的原因是:①加快反应速率;②_______________________________。
(2)工业上用传感器检测反应容器中的气体压强,当压强保持不变时,表面反应已达平衡。能通过检测压强判断反应是否达到平衡状态的理由是__________________________。
(3)实验时,在3~4min之间改变了某一条件造成平衡移动。表中数据说明平衡向____移动(填“左”或“右”);达到新平衡后,与原来相比平衡常数_______(填“变大”、“变小”、“不变”)。
(4)Cl2也可用于制备新型净水剂高铁酸钠(Na2FeO4)。配平制备反应的化学方程式___Fe(NO3)3+___NaOH+___Cl2→___Na2FeO4+___NaNO3+___NaCl+___H2O若反应消耗3.36L Cl2(标准状况),则转移电子的数目是________。
(5)用Na2FeO4杀菌消毒的优点是还原产物具有净水作用,缺点是还原产物会对铁制水管造成腐蚀,造成腐蚀的原理有________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是

A. 简单离子的半径大小关系:B>C>E
B. C元素的气态氢化物比D元素的气态氢化物稳定是氢键的缘故
C. 由A、B两种元素组成的离子化合物NH5中,阴、阳离子个数比为1:1
D. 由C、D、E三种元素组成的某种化合物,其水溶液能与盐酸反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com