
下列离子方程式正确的是 ( )
A.NaHCO3溶液与NaOH溶液反应:HCO3-+OH-=CO32-+H2O
B.少量二氧化碳通入足量的KOH溶液:CO2+OH-=
C.Fe与稀硝酸反应产生:2Fe+6H+=2Fe3++3H2↑
D.氨水和醋酸溶液混合NH3·H2O+H+=NH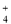 +H2O
+H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届内蒙古高三上第一次月考化学试卷(解析版) 题型:选择题
下列解释事实的方程式不正确的是
A.向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O ═ CaCO3↓+2H+
B.用Fe2(SO4)3做净水剂:Fe3+ + 3H2O Fe(OH)3(胶体) + 3H+
Fe(OH)3(胶体) + 3H+
C.水垢中的CaSO4用Na2CO3溶液处理:CaSO4+ CO32-═ CaCO3 +SO42-
D.向5 mL 0.1 mol·L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第一次月考化学试卷(解析版) 题型:选择题
某有机物与过量的金属钠反应,得到VA升气体,另一份等质量的该有机物与纯碱反应得到气体VB升(同温、同压),若VA>VB,则该有机物可能是( )
A.HOCH2CH2OH B.HOOC- CH2CH2-OH C.HOOC-COOH D.CH3COOH
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第一次月考化学试卷(解析版) 题型:选择题
亚氨基锂(Li2NH)是一种储氢容量高,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是( )
A.Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第一次月考化学试卷(解析版) 题型:选择题
标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③5.6g CH4 ④0.5mol HCl,下列关系正确的是( )
A.体积大小:④>③>②>①
B.原子数目:③>①>④>②
C.密度大小:④>②>③>①
D.质量大小:④>③>②>①
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上9月综合能力测试化学试卷(解析版) 题型:填空题
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2 CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
实验序号 | 温度℃ | 初始CCl4浓度(mol·L﹣1) | 初始H2浓度(mol·L﹣1) | CCl4的转化率 |
1 | 110 | 1 | 1 | 50% |
2 | 100 | 1 | 1 | x |
3 | 110 | 0.8 | y | 60% |
(1)实验1中,10h后反应达到平衡,则从反应开始至达到平衡状态,H2的平均反应速率为 mol·L﹣1·h﹣1.在此实验的平衡体系中,再加入0.5mol CCl4和0.5mol HCl,平衡将怎样移动? (填“向左移动”、“向右移动”、“不移动”或“无法确定”).
(2)实验2中,x为 (填字母).
A.等于50% B.大于50% C.小于50% D.无法确定
(3)实验3中的y为 .
(4)在100℃条件下,能说明反应CCl4+H2 CHCl3+HCl△H<O达到平衡状态的是 (填字母).
CHCl3+HCl△H<O达到平衡状态的是 (填字母).
A.压强不再变化 B.生成HCl的速率和消耗H2的速率相等
C.混合气体的密度不变 D.H2的质量不再变化
(5)用电解法处理高浓度重铬酸钠废水具有效果稳定可靠,操作管理简单,设备占地面积小,废水中的重金属离子也能通过电解有所降低等优点,其原理是铁作电极,在酸性条件下,将Cr6+还原为Cr3+,其装置示意图如图所示.
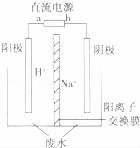
若以甲醚燃料电池为直流电源(电解质溶液为KOH溶液),则燃料电池中b极应通入 ,a极的电极反应为 .
能否用铜作电解重铬酸钠废水的电极? (填“能”或“不能”),理由是
③除去重铬酸根离子的离子反应是 .
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期9月月考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式的是( )
A.向FeI2溶液中加入少量氯水2Fe2++Cl2=2Fe3++2Cl-
B.NaClO (aq) 中通入过量 SO2: C1O- + SO2 + H2O = HClO +HSO3-
C.氯气通入水中:Cl2+H2O=2H++Cl-+ ClO-
D.次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三暑假阶段性考试化学试卷(解析版) 题型:选择题
铋(Bi)位于元素周期表中第ⅤA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应实验现象如表所示:
加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI?淀粉溶液 |
实验现象 | 溶液呈紫红色 | 溶液紫红色消失,产生气泡 | 溶液变成蓝色 |
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.I2、H2O2、KMnO4、NaBiO3 B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2 D.KMnO4、NaBiO3、I2、H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com