
汽车排放出的尾气主要是一氧化碳、一氧化氮、碳氢化合物等污染物。其中一氧化氮在空气中会生成二氧化氮,二氧化氮存在着一个可逆过程:2NO2(g)  N2O4(g) ΔH=Q kJ/mol。若将一定量的NO2(g)充入到一定温度下的某容积可变的密闭容器中,建立化学平衡,下列说法正确的是( )
N2O4(g) ΔH=Q kJ/mol。若将一定量的NO2(g)充入到一定温度下的某容积可变的密闭容器中,建立化学平衡,下列说法正确的是( )
A.若容积为某一固定值,当体系的压强不再发生变化时说明达到化学平衡状态
B.若上述可逆反应达化学平衡状态后,给平衡体系加压(缩小容积,其他条件不变),则容器内气体的平均摩尔质量将减小
C.若上述可逆反应达到化学平衡状态后,升高温度(其他条件不变)体系颜色加深,则Q>0
D.对于上述可逆过程给平衡体系减压(增大容积,其他条件不变),可以提高N2O4的产率
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(1)(8分)糖类、油脂、蛋白质都是人体必需的营养物质。①油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和________(写名称),进而被氧化生成二氧化碳和水并提供能量。
②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(—NH2)和________(写结构简式或名称)。人体中共有二十多种氨基酸,其中人体自身________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
③淀粉在人体内酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式:_________________________________________。
(2)《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(CH3COOCH2)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
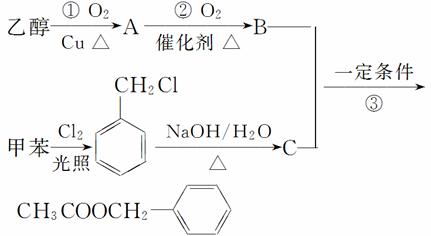
①C的结构简式为________________________________。
②写出反应①的化学方程式:______________________。
③反应③的反应类型为____________________________。
④反应________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理常采用:
2NaClO3 + 4HCl = 2ClO2↑+Cl2↑+2H2O+2NaCl,下列关于该反应的说法中正确的是
A.浓盐酸在反应中仅体现还原性 B.每生成0.lmol ClO2转移0.5mol电子
C.氧化性:NaClO3 <ClO2 D.被氧化和被还原的物质的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是___▲____。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是___▲____(填字母)。

②乙装置中FeCl2溶液与Cl2反应的离子方程式是___▲____。证明FeCl2与Cl2发生了氧化还原反应的实验方法是___▲____。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是___▲____。
④该实验存在明显的缺陷,改进的方法是___▲____。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2S2O3+I2 === Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为___▲____。
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,在300℃、70 MPa下,由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
下列叙述错误的是( )
A.使用CuZnFe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g)+bB(g)  cC(g)+dD(s) ΔH=Q kJ·mol-1,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图Ⅰ所示,反应速率(v)与压强(p)的关系如图Ⅱ所示。据图分析,以下说法正确的是( )
cC(g)+dD(s) ΔH=Q kJ·mol-1,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图Ⅰ所示,反应速率(v)与压强(p)的关系如图Ⅱ所示。据图分析,以下说法正确的是( )
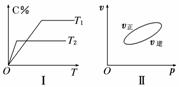
A.T1<T2,Q<0
B.增大压强,B的转化率减小
C.当反应达到平衡时,混合气体的密度不再变化
D.a+b>c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
下列相关反应的离子方程式书写错误的是
A.在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+4OH-+2Fe(OH)3===3Cl-+5H2O+2FeO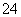
B.过量SO2通入苯酚钠溶液中:
2C6H5O-+SO2+H2O===2C6H5OH+SO
C.用稀硫酸酸化的KMnO4溶液与H2O2反应:
2MnO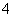 +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
D.FeSO4酸性溶液暴露在空气中:
4Fe2++O2+4H+===4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K= 。有关该平衡体系的说法正确的是( )
。有关该平衡体系的说法正确的是( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com