
��101kPa��25��ʱ���з�Ӧ���Ȼ�ѧ����ʽ![]()
H2(g) + 1/2O2(g) =H2O(g) ��H=-241.8kJ/mol![]()
H2(g) + 1/2O2(g) =H2O(1) ��H=-285.8kJ/mol![]()
����˵���д�����ǣ�( )![]()
A.H2ȼ������1molH2O(g)ʱ���ų�241.8kJ������ ![]()
B.H2��ȼ����Ϊ285.8kJ![]()
C.O2 ǰ���1/2��ʾ�μӷ�Ӧ��O2�����ʵ��� ![]()
D.1molҺ̬ˮ���ˮ����ʱ����44kJ������![]()
 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| A��-41kJ?mol-1 |
| B��+41kJ?mol-1 |
| C��-152kJ?mol-1 |
| D��-263kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�찲��ʡ�߶���һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��101kPa��25��Cʱ���йط�Ӧ���Ȼ�ѧ����ʽ���£�
C(s)+1/2 O2(g)=CO(g) ��H1= -110.5KJ/mol
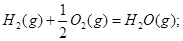
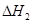 =
=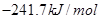
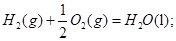
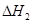 =
=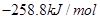
����˵����ȷ���ǣ� ��
A��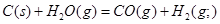 ��
��
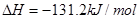
B��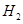 ȼ���ȵĻ�ѧ����ʽΪ��
ȼ���ȵĻ�ѧ����ʽΪ��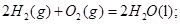
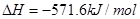
C��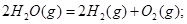
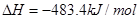
D��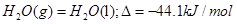
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ɽ��ʡ�߶���ѧ��ģ���⻯ѧ�Ծ� ���ͣ�ѡ����
��101kPa��25��ʱ���������Ȼ�ѧ����ʽ��
H2(g) + 1/2O2(g) =H2O(g)����H=-241.8kJ/mol��
H2(g) + 1/2O2(g) =H2O(1)����H=-285.8kJ/mol������˵���д������
A.H2ȼ������1molH2O(g)ʱ���ų�241.8kJ������
B.H2��ȼ����Ϊ285.8kJ
C.O2 ǰ���1/2��ʾ�μӷ�Ӧ��O2�����ʵ���
D.1molҺ̬ˮ���ˮ����ʱ����44kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010���㽭ʡ�㶫����У�߶��ڶ�ѧ������������ѧ���� ���ͣ�ѡ����
��101kPa��25��ʱ���Ȼ�ѧ����ʽ��H2(g) + 1/2O2(g) =H2O(g)����H=-241.8kJ/mol��H2(g) + 1/2O2(g) =H2O(1)����H=-285.8kJ/mol������˵���д�����ǣ� ( )
A��H2ȼ������1molH2O(g)ʱ���ų�241.8kJ������
B��H2��ȼ����Ϊ285.8kJ
C��O2 ǰ���1/2��ʾ�μӷ�Ӧ��O2�����ʵ���
D��1molҺ̬ˮ���ˮ����ʱ����44kJ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com