
【题目】有机物E是一种药物中间体,合成路线如下:

(1)该路线中设计第Ⅰ、Ⅲ步的目的是________。
(2)步骤Ⅳ中X的结构简式为________。
(3)1 mol E与足量的H2反应,最多消耗H2_________mol。
(4)F是C的一种同分异构体,能与新制的氢氧化铜反应生成红色沉淀,遇FeCl3溶液显紫色,分子中含有4种不同环境的氢。F的结构简式为_________。
【答案】保护酚羟基(防止被氧化) 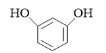 7
7 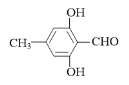 或
或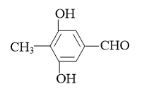
【解析】
A在K2CO3作用下和CH3I发生取代反应生成B,B中的甲基被高锰酸钾溶液氧化生成C,C在与HI发生反应生成D ,D与C6H6O2发生取代反应生成E,结合E的结构简式,可知X的结构简式为 ,据此分析解答。
,据此分析解答。
(1)该路线中设计第Ⅰ将酚羟基转化为醚键,第Ⅲ步将醚键转化为酚羟基,由于第Ⅱ步中使用高锰酸钾溶液氧化甲基,第Ⅰ、Ⅲ步目的是保护酚羟基(防止被氧化);
(2)根据分析,结合E和D的结构简式可知,步骤Ⅳ中X的结构简式为 ;
;
(3)E中含有羰基和苯环,都能与氢气发生加成反应,则1 mol E与足量的H2反应,最多消耗7mol H2;
(4)F是C的一种同分异构体,能与新制的氢氧化铜反应生成红色沉淀,说明结构中含有醛基,遇FeCl3溶液显紫色,说明结构中含有酚羟基和苯环,分子中含有4种不同环境的氢,结合C的结构简式,F的结构简式为 或
或 。
。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】中国科学家在合成氨(N2+3H2![]() 2NH3 △H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )
2NH3 △H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )
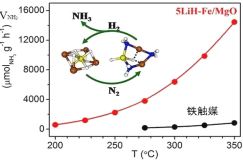
A.过程中有极性键形成
B.复合催化剂降低了反应的活化能
C.复合催化剂能降低合成氨反应的焓变
D.350℃,催化效率:5LiH-Fe/MgO>铁触媒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,下列叙述不正确的是( )

A. K与N连接时,铁被腐蚀
B. K与N连接时,石墨电极产生气泡
C. K与M连接时,一段时间后溶液的pH增大
D. K与M连接时,开始阶段石墨电极反应:4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E是一种除草剂,常通过如下方法合成:
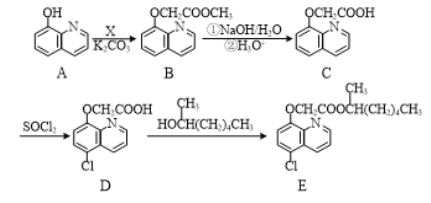
(1)化合物B中的含氧官能团的名称为酯基和_________。
(2)A与X发生反应生成B和HCl,则X的结构简式为_________________。
(3)D→E的反应类型为___________。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式:_____________。
Ⅰ.分子中含有1个苯环,且有5个碳原子位于同一直线上。
Ⅱ.能与新制Cu(OH)2悬浊液反应。
Ⅲ.分子中含有4种化学环境不同的氢。
(5)已知:①CH3CHO![]() ClCH2CHO。②ClCH2CHO也能发生X在流程A→B中的类似反应。
ClCH2CHO。②ClCH2CHO也能发生X在流程A→B中的类似反应。
写出以苯酚和乙醛为原料合成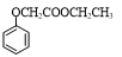 的合成路线流程图(无机试剂可任选)_______________。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂可任选)_______________。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。

已知:P204[二(2乙基己基)磷酸酯]常用于萃取锰,P507(2乙基己基膦酸2乙基己酯)和Cyanex272[二(2,4,4)三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式__________________________________。
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:

加入NaOH溶液调pH=5可除去图中的________(填金属离子符号)杂质;写出除去金属离子的离子方程式________________________(一种即可)。
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)![]() MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)![]() MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。

■—Co(Cyanex272);●—Ni(Cyanex272);▲—Co(P507);▼—Ni(P507)
由图可知,钴、镍的萃取率随萃取剂浓度增大而_________(填“增大”或“减小”);两种萃取剂中___________(填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为__________mol·L1;若选Cyanex272萃取剂,则最适宜的萃取剂浓度大约为___________mol·L1。
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×1016,则沉镍母液中Ni2+的浓度为2.1×1011 mol·L1时,pH=______(lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A为原料通过一步反应即可制得重要有机化工产品P(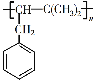 )。下列说法错误的是
)。下列说法错误的是
A.A的分子式为C11H14,可发生取代、氧化、加成等反应
B.由A生成P的反应类型为加成聚合反应,反应过程没有小分子生成
C.A的结构简式为![]() ,分子中所有碳原子不可能共面
,分子中所有碳原子不可能共面
D.1 mol A最多能与4 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和实验现象所得出的结论,正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 试样已经氧化变质 |
B | 乙醇和浓硫酸混合加热至170℃,将产生气体通入酸性KMnO4溶液 | 紫红色褪去 | 使溶液褪色的是乙烯 |
C | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
D | 将炽热的木炭与浓硝酸混合所得气体通入澄清石灰水中 | 澄清石灰水不变浑浊 | 验证碳的氧化产物为CO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)下列物质中属于天然有机高分子化合物的是(填序号)____________________
①淀粉 ②油脂 ③高级脂肪酸 ④纤维素 ⑤蚕丝 ⑥聚乙烯塑料 ⑦涤纶
(2)写出该有机物![]() 的结构简式______________________________________它所属的类别为____________________(填序号)
的结构简式______________________________________它所属的类别为____________________(填序号)
①卤代烃 ②脂肪族化合物 ③脂环化合物 ④烯烃 ⑤烃的衍生物
(3)0.lmol某烃在足量的O2中燃烧,生成13.2gCO2和5.4gH2O,该烃的分子式为_______
(4)写出丙烯发生加聚反应的化学方程式_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源,以太阳能为热能,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应I的化学方程式是________。
(2)反应I得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层,含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是________(选填序号)。
a 两层溶液的密度存在差异
b 加I2前,H2SO4溶液和HI溶液不互溶
c I2在HI溶液中比在H2SO4溶液中易溶
② 辨别两层溶液的方法是____________。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因______。
(3)反应II : 2H2SO4(l)=2SO2(g) +O2(g) +2H2O(g) △H=+550 kJ mol-1
它由两步反应组成:
i.H2SO4(l)=SO3(g) +H2O(g) △H =+177 kJ mol-1
ii.SO3(g)分解。
L(L1, L2)和X可分别代表压强或温度,下图表示L一定时,ⅱ中SO3(g)的平衡转化率随X的变化关系。

①写出反应iiSO3(g)分解的热化学方程式:________。
②X代表的物理量是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com