
(16分)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子反应方程式表示) 。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是 。
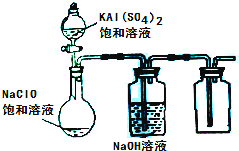
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是 。
②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生。充分反应后集气瓶中气体能使带余烬的木条复燃。写出在光照下混合液中反应的化学方程式是
。
(4)若将V1 mL 0.1mol/L KAl(SO4)2溶液和V2mL 0.1mol/LBa(OH)2溶液混合。当产生沉淀物质的量最多时,V1:V2 = 。
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:阅读理解
 (2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子反应方程式表示) 。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是 。
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。
① 打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀 。反应的离子方程式是 。
② 将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生。充分反应后集气瓶中气体能使带余烬的木条复燃。写出在光照下混合液中反应的化学方程式是
。
(4)若将V1 mL 0.1mol/L KAl(SO4)2溶液和V2mL 0.1mol/LBa(OH)2溶液混合。当产生沉淀物质的量最多时,V1:V2 = 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省达州市高三第一次诊断性考试理综化学试卷(解析版) 题型:填空题
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为
电解后的溶液PH 7(填大于、小于、等于);其原因是 (用离子方程式表示)
(2)KAl(SO4)2溶液中质子守恒等式为
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。

①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。此时反应的离子方程式为
。
②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体。写出在光照射下混合液中反应的化学方程式是 。
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4·FeSO4)溶液,其他不变。打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液。观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生。此时烧瓶中发生的氧化还原反应的离子方程式为
。
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为 (忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省中山市高三化学模拟试卷(八) 题型:实验题
(16分)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子反应方程式表示) 。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是 。
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。

① 打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀 。反应的离子方程式是 。
② 将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生。充分反应后集气瓶中气体能使带余烬的木条复燃。写出在光照下混合液中反应的化学方程式是
。
(4)若将V1 mL 0.1mol/L KAl(SO4)2溶液和V2mL 0.1mol/LBa(OH)2溶液混合。当产生沉淀物质的量最多时,V1:V2 = 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com