
【题目】(1)已知H-H 键能为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据化学方程式: N2(g)+3 H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是_________________
2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是_________________
(2)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________________。
A.C(s) + H2O(g) = CO(g) + H2(g) △H > 0
B.2H2(g)+O2(g)=2H2O(1) △H < 0
C.NaOH(aq) + HC1(aq) = NaC1(aq) + H2O(1) △H < 0
(3)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式___________。
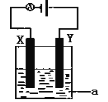
(4)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中为 a电解液,X和Y均为惰性电极,则
①若a为CuSO4溶液,则电解时的化学反应方程式为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的pH=_______(假设电解后溶液体积不变)。
③若用此电解装置模拟工业精炼铜,则应将a改为 溶液
【答案】(1)945.6 kJ·mol-1 ;(2)B; (3)O2 +4e- +2H2O =4OH- ;
(4)① 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4;
2Cu+O2↑+2H2SO4;
② 1; ③CuSO4
【解析】
试题分析:(1)已知:H-H键能为436kJmol-1,N-H键键能为391kJmol-1,令N≡N的键能为x,
对于反应N2(g)+3H2(g)═2NH3(g)△H=-92.4kJmol-1;反应热△H=反应物的总键能-生成物的总键能,故x+3×436kJmol-1-2×3×391kJmol-1=-92.4kJmol-1 解得:x=945.6kJmol-1;
(2)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;C.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;故答案为C;
(3)以KOH溶液为电解质溶液,氢氧燃料碱性电池中,负极上氢气失去电子,正极上氧气得电子发生还原反应,电极反应式为O2 +4e- +2H2O =4OH- ;
(4)①电解硫酸铜溶液时,阳极上生成氧气,阴极上生成铜,同时溶液中生成硫酸,所以电池反应式为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4;
2Cu+O2↑+2H2SO4;
②电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,阳极上先生成氯气后生成氧气,阴极上先生成铜,后生成氢气,阳极上氯气完全析出时,氯气的体积=![]() ×22.4L/mol=448mL<672mL,所以阳极上还有224mL氧气,阳极上转移电子的物质的量=0.04mol×1+
×22.4L/mol=448mL<672mL,所以阳极上还有224mL氧气,阳极上转移电子的物质的量=0.04mol×1+![]() =0.08mol,阴极上铜完全析出时,需要电子的物质的量=0.04mol×2=0.08mol,所以阴极上不析出氢气,生成224mL氧气时,阳极附近同时生成C(H+)=
=0.08mol,阴极上铜完全析出时,需要电子的物质的量=0.04mol×2=0.08mol,所以阴极上不析出氢气,生成224mL氧气时,阳极附近同时生成C(H+)=![]() =0.1mol/L,所以溶液的pH=1;
=0.1mol/L,所以溶液的pH=1;
③工业精炼铜时,阳极是粗铜,电解液为含铜离子的溶液CuSO4或CuCl2。


科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)
![]()
![]()
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要.下列物质中用于制造光导纤维的材料是( )
A.铜合金 B.陶瓷 C.聚乙烯 D.二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下图所示为实验室常见气体制备、净化、干燥、收集和性质等实验所用到的部分仪器,某校化学兴趣小组利用这些仪器进行实验探究,请你参与实验并完成有关问题:
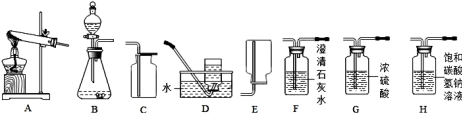
(1)甲组同学用加热高锰酸钾的方法制取氧气,应选择的发生装置为 (填字母序号);若他们选用D装置来收集O2,当气体收集满后,从水槽中取出集气瓶的操作为 。
(2)乙组同学以石灰石和稀盐酸为原料,制备并收集一瓶干燥、纯净的二氧化碳气体,按要求设计实验装置、连接仪器、并检验装置的气密性、所选仪器的连接顺序应为: → → → ;请用离子方程式表示H瓶中饱和NaHCO3溶液的作用: ;若将少量二氧化碳气体通入澄清石灰水中,发生反应的离子方程式为 。
Ⅱ.某校化学实验室有四瓶失去标签的溶液,分别标为A、B、C、D,已知它们是碳酸钠溶液、氯化钡溶液、硫酸钠溶液和稀盐酸中的一种。该校化学兴趣小组的同学进行以下实验探究来鉴别这四种溶液。
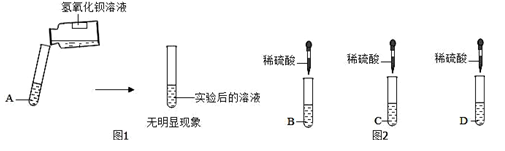
(3)丙同学的实验操作如图1所示,由此你推断该同学认为A一定不是 ;然后他再接着向实验后的混合溶液中滴加酚酞试液,发现混合溶液由无色变为红色,则丙同学得出结论:A一定是氯化钡溶液。
(4)丁同学则不同意丙同学的结论,你认为丁同学的理由是 ;于是丁同学另取少量A于试管中,向其中滴加一种试剂为 (注:只能从下列备选试剂中选择一种!),根据所选试剂他应该观察到的明显现象为 ;
A.饱和食盐水 B.K2CO3溶液 C.蒸馏水 D.紫色石蕊试液
由此证明了丙同学的结论是错误的;同时也确定了A的成分。
(5)戊同学的实验操作如图2所示,实验时观察到C中产生气泡,D中产生白色沉淀。写出D中发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为______ ___。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 。
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-)
D.c(HCN)+ c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_____________________。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;电荷守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,转移的电子的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料。
(1)已知:CH4(g)+H2O==CO+3H2(g) △H=206.2 kJ·mol-1。
CH4(g)+CO2(g)==2CO(g)+2H2(g) △H=247.4 kJ·mol-1
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为___________________。
(2)工业合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ·mol-1。
2NH3(g) △H=-92.4 kJ·mol-1。
某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测 得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(NH3)=__________mol·L-1·min-1,该温度下该反应的平衡常数K=________。 欲增大氮气的平衡转化率,可采取的措施有_____________、____________等(共写两条措施即可,每空一条)。
(3)下图所示装置工作时均与H2有关。
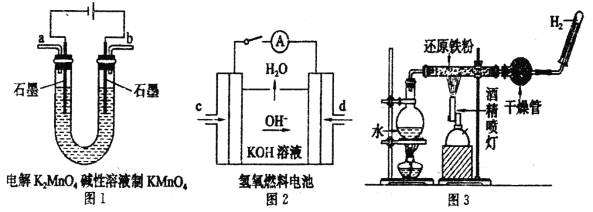
图l所示装置中阳极的电极反应式为______________。
②图2所示装置中,通入H2的管口是_____________(选填字母代号)。
③某同学按图3所示装置进行实验,实验结束后.将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液。溶液不变红,再滴入新制氯水,溶液变为红色。该同学据此得出结论:铁与水蒸气反应生成FeO和H2。该结论_____________(填“严密”或“不严密”),你的理由是(用离子方程式和必要的文字说明)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯最初是从煤焦油中回收,大约从1865年开始了工业生产。随着它用途的扩大,到1930年已经成为世界十大吨位产品之一。将苯分子的一个碳原子换成一个氮原子,得到一个类似于苯环结构的稳定有机物,此有机物的相对分子量为( )
A. 81 B. 80 C. 79 D. 78
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com