

| ���������� | �������↑ʼ����ʱ��pH | ����������ȫ����ʱ��pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
| ||
| ���� |
| ||
| ���� |
| ||
| ���� |
| ||
| ���� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���������� | �������↑ʼ����ʱ��pH | ����������ȫ������pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
| ||
| ||

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���������� | �������↑ʼ����ʱ��pH | ����������ȫ����ʱ��pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |

| ||
| ���� |
| ||
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| �������� | Fe��OH��3 | Al��OH��3 | Mg��OH��2 |
| ��ʼ����pH | 1.5 | 3.3 | 9.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���ս̰���л�ѧѡ��2 2.4 þ������ұ����ϰ���������棩 ���ͣ������
����ʯ����Կ�����MgO��Fe2O3��Al2O3��SiO2��ɡ�������ʯ��ȡ��ʽ̼��þ��ʵ�鲽�����£�
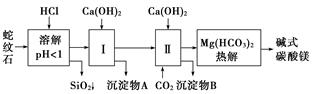
(1)����ʯ��������ܽ����Һ�����Mg2���⣬�����еĽ���������__________________��
(2)���Т����ʱ��������ҺpH��7��8(�й��������������pH���±�)��
|
�������� |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
��ʼ����pH |
1.5 |
3.3 |
9.4 |
Ca(OH)2���ܹ�������Ca(OH)2�������ܻᵼ��________�ܽ⡢________������
(3)�ӳ��������A����ȡ��ɫ�����������ϣ����������A�м���_____________________ ___________________________________________________(�������ʵĻ�ѧʽ)��
Ȼ��______________________________________________________________________(������дʵ���������)��
(4)����ѭ��ʹ�ã��ܽ�Լ��Դ������ʵ���У�����ѭ��ʹ�õ�������________(��д���ʻ�ѧʽ)��
(5)�����һ��ʵ�飬ȷ����ƷaMgCO3��bMg(OH)2��cH2O��a��b��c��ֵ������������ʵ�鲽��(�����Լ���Ũ���ᡢ��ʯ��)��
����Ʒ����
�ڸ��·ֽ�
��________________________________________________________________________
��________________________________________________________________________
��MgO����
(6)18.2 g��Ʒ��ȫ�ֽ����6.6 g CO2��8.0 g MgO���ɴ˿�֪����Ʒ�Ļ�ѧʽ�У�
a��________��b��________��c��________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com