
| A. | 元素 A、B 组成的化合物常温下一定呈气态 | |
| B. | 元素 D 的最高价氧化物对应的水化物不是两性化合物 | |
| C. | 元素 C 的最高价氧化物对应的水化物是弱碱 | |
| D. | 化合物 AE 与 CE 有相同类型的化学键 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,只能有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于碳,则C为Na元素;元素D的单质是金属,它与冷水反应缓慢,与沸水反应迅速,原子序数大于钠,故D为Mg;元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,则A为H元素,E的原子序数大于Mg元素,E为Cl元素,据此解答.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,只能有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于碳,则C为Na元素;元素D的单质是金属,它与冷水反应缓慢,与沸水反应迅速,原子序数大于钠,故D为Mg;元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,则A为H元素,E的原子序数大于Mg元素,E为Cl元素.
A.元素A、B组成的化合物属于烃类物质,常温下可能为气态、液体、固体,如烷烃中C原子数少于4个为气体,随碳原子个数增多,为液体、固体,故A错误;
B.元素 D 的最高价氧化物对应的水化物是氢氧化镁,不是两性化合物,故B正确;
C.元素C的最高价氧化物对应的水化物为NaOH,属于强碱,故C错误;
D.化合物AE为HCl,含共价键,CE为NaCl,含离子键,化学键类型不同,故D错误;
故选B.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题的关键,注意掌握元素的性质及单质化合物的性质.


科目:高中化学 来源: 题型:填空题
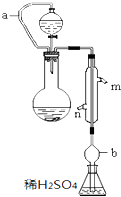 实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:| 实验 次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5.22 |
| 2 | 6.00 | 11.18 |
| 3 | 12.00 | 17.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①④⑤ | C. | ①⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中加入CH3COONa晶体 | D. | 向水中加入NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加酸性高锰酸钾溶液,振荡 | B. | 加NaOH溶液,加热 | ||
| C. | 加新制氢氧化铜悬浊液,加热 | D. | 加Na2CO3溶液,加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达平衡时同一物质的V(正)=V(逆) | B. | 是动态平衡 | ||
| C. | 各组分的含量不随时间而变化 | D. | 外界条件不能改变平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | b | ||||||
| e | f | g | |||||
| c | d | h | i | j | |||
 ,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com