
| A、①分液、②过滤、③萃取、分液 | B、①过滤、②过滤、③萃取、分液 | C、①分液、②分液、③萃取、分液 | D、①分液、②过滤、③过滤 |
科目:高中化学 来源: 题型:阅读理解
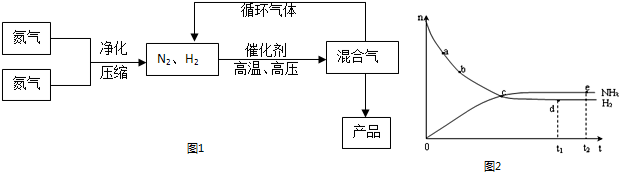
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

反应体系中各组分的部分性质见下表:
气体 | 氮气 | 氢气 | 氨 |
熔点/℃ | -210.01 | -252.77 | -77.74 |
沸点/℃ | -195.79 | -259.23 | -33.42 |
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程,即反应后通过把混合气体的温度降低到____________,使混合气体分离出产品,N2、H2继续循环。写出该反应的化学平衡常数表达式:K=____________。
(2)运用化学反应速率和化学平衡的观点说明工业上采用“使混合气体分离出产品,N2、H2继续循环”的生产措施的理由:___________________________________________________。
(3)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_____________________________。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图甲所示。下列叙述正确的是____________。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大
(5)1998年希腊亚里斯多德大学的Marncellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如下图乙。阴极的电极反应式为__________________________________________________________________。


甲 乙
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
A.生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式_________________________。
(2)根据等电子原理,写出CO分子的结构式______________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是_____________________;甲醛分子中碳原子轨道的杂化类型为_____________________。
②甲醛分子的空间构型是_____________________;1 mol甲醛分子中σ键的数目为_____________________。

③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为_____________________。
B.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:

环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3, | 溶解性 |
环己醇 | 161.1(97.8)* | 0.962 4 | 能溶于水 |
环己酮 | 155.6(95)* | 0.947 8 | 微溶于水 |
水 | 100.0 | 0.998 2 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~
①酸性Na2Cr2O7溶液的加料方式为_____________________。
②蒸馏不能分离环己酮和水的原因是_____________________。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~
①上述操作的正确顺序是_______________________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需_______________。
③在上述操作c中,加入NaCl固体的作用是_______________________________________
______________________________________________________________________________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有______________种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源:2013届安徽省高二第二次月考理科综合试题(化学部分) 题型:填空题
(15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)  2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:

|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 ℃使混合气体分离出来产品;继续循环的气体是 。
(2)工业上采取用上述(1)操作的目的:
。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________ 。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是

A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com