下列是芳香族化合物A、B、C、D、E的转化关系,其中A、E分子式分别是C9H8O和C9H8O2,E分子中除苯环外还含有一个六元环,且E中不含甲基。根据下列转化关系回答问题:
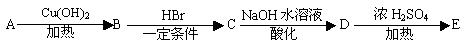
(1)写出A分子中所含官能团的名称________________________________。
(2)完成方程式,并分别写出反应类型
A→B___________________________________________反应类型??????????????__________________。
B→C___________________________________________反应类型??????????????__________________。
(3)写出E的结构简式______________________________。
(4)要中和16.6gD,需要2mol/LNaOH溶液的体积为_________mL。
(5)符合下列条件的D的同分异构体共有_________种,写出其中任意一种同分异构体的结构简式______________________________________。
①苯环上有两个取代基 ②能与FeCl3溶液发生显色反应 ③能发生水解反应和银镜反应

