
分析 恒温条件下将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则
3A(g)+B(g)?2C(g)+2D(g),
起始 0 0
转化 1.2mol 0.4mol 0.8 mol 0.8 mol
平衡 1.8mol 0.6mol 0.8 mol 0.8 mol
所以A反应前的物质的量为1.2mol+1.8mol=3.0mol,以此解答该题.
解答 解:恒温条件下将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则
3A(g)+B(g)?2C(g)+2D(g),
起始 0 0
转化 1.2mol 0.4mol 0.8 mol 0.8 mol
平衡 1.8mol 0.6mol 0.8 mol 0.8 mol
所以A反应前的物质的量为1.2mol+1.8mol=3.0mol,
(1)反应前C的物质的量为0.反应后C的物质的量为0.8mol,所以C的物质的量的变化量为0.8mol,
v(C)=$\frac{△C}{△t}=\frac{△n}{V△t}=\frac{0.8mol}{2L\;.10s}$=0.04mol•L-1•s-1
故答案为:0.04mol•L-1•s-1;
(2)cA)=$\frac{n}{V}=\frac{3.0mol}{2L}$=1.5 mol•L-1;
故答案为:1.5 mol•L-1;
(3)平衡时A的转化率为$\frac{1.2}{3}×100%$=40%,故答案为:40%;
(4)A.反应速率之比等于化学计量数之比,无论是否平衡都存在消耗3mol A同时生成2mol C,不能说明达到平衡状态,故A错误;
B.反应体系中各物质的百分含量不变,可说明达到平衡状态,故B正确;
C.由于反应前后气体的质量、物质的量都不变,则混合气体平均相对分子质量不变,不能说明达到平衡状态,故C错误;
D.2V正(A)=3V逆(C),可说明正逆反应速率相等,达到平衡状态,故D正确.
故答案为:BD.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析、计算能力的考查,题目涉及化学反应速率的定量表示方法,知道“在温度、体积不变的密闭容器中,反应前后气体的物质的量之比等于压强之比”,是解题的关键,难度不大.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝热反应是炼铁最常用的方法 | |
| B. | 硅是现代光学及光纤制品的基本原料 | |
| C. | 采用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法可提高空气质量 | |
| D. | 袋装食品常用生石灰包作为食品的抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
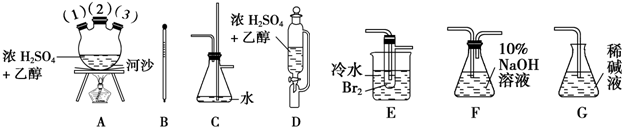
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
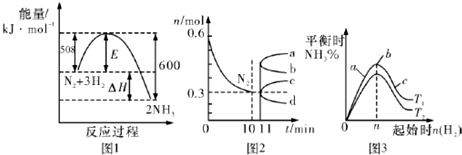
| A. | 升高温度,该反应的平衡常数增大 | |
| B. | 由图2信息,10 min内该反应的平均速率v(H2)=0.09 mol•L-1•min-1 | |
| C. | 由图2信息,从11 min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d | |
| D. | 图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
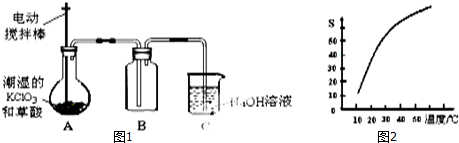

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
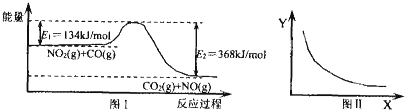
| A. | 该反应的焓变△H=+234 kJ•mol-1 | |
| B. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 | |
| C. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| D. | 若X表示反应时间,则Y表示的可能是混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
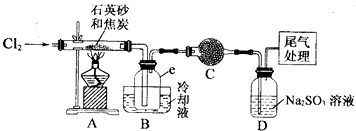
| 物质 | SiC14 | A1C13 | FeC13 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
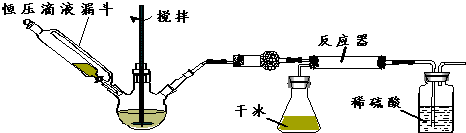
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
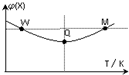 在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | 升高温度,平衡常数增大 | |
| B. | W点X的正反应速率小于M点X的正反应速率 | |
| C. | Q点时,Y的转化率最小 | |
| D. | 平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com