
下列说法正确的是( )
| A.铜和铁与FeCl3溶液构成的原电池中:Cu +2 Fe3+ = Cu2+ + 2Fe2+ |
| B.铁上镀锌时阴极析出6.5g锌,溶液中减少Zn2+数为0.1mol |
| C.在反应:4CuS + 5O2 = 2Cu2O + 4SO2中CuS既是氧化剂又是还原剂 |
| D.生铁与浓H2SO4加热反应可产生SO2和CO2气体 |
CD
解析试题分析:铜和铁与FeCl3溶液构成的原电池中,铁比铜活泼,铁做负极,因此反应原理是Fe +2 Fe3+ = 3Fe 2+ ,A错误;电镀池是以含有电镀金属离子的溶液做为电解液的,阳极是待镀金属,因此铁上镀锌时阴极析出6.5g锌,溶液中的Zn2+不减少,B错误;在反应4CuS + 5O2 = 2Cu2O + 4SO2中CuS中Cu化合价降低,而S的化合价升高,因此CuS既是氧化剂又是还原剂,C正确;生铁中有单质Fe和C,二者均可以在加热条件下和浓硫酸反应,因此有SO2和CO2气体产生,D正确;故选CD。
考点:本题考查的是电化学基础知识、氧化还原反应、金属与非金属单质与酸的反应知识。


科目:高中化学 来源: 题型:单选题
X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,Q的最外层电子数与其电子总数比为3:8,P的单质常用作电脑的芯片材料。
| A.元素Y、P的简单氢化物中化学键类型相同 |
| B.原子半径:X>Y |
| C.最高价氧化物的水化物酸性:P<Q |
| D.X、Q两元素的最高正化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列陈述和判断均正确,且有因果关系的是( )
| 选项 | 陈述 | 判断 |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 在未知溶液中加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液含有SO42- |
| C | 铁、铜、汞、银的金属活动性顺序为Fe>(H)>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,铁和铜必须用还原剂,汞和银只需加热 |
| D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )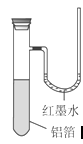
| A.实验中发生的反应都是氧化还原反应 |
| B.铝是一种较活泼的金属 |
| C.铝与氧气反应是放热反应 |
| D.铝片上生成的白毛是氧化铝和氧化汞的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | 稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2 | 稀硝酸氧化性比浓硝酸强 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。如图表示了三种金属被人类开发利用的大致年限。之所以有先后,主要取决于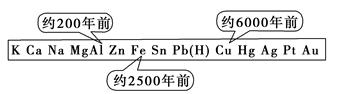
| A.金属的化合价高低 | B.金属的活动性大小 |
| C.金属的导电性强弱 | D.金属在地壳中的含量多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:Li与Mg、Be与Al的性质相似。下列判断正确的是
| A.LiOH是强碱 |
| B.Be与冷水剧烈反应 |
| C.Li在空气中不易被氧化 |
| D.Be(OH)2能与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com