
��14�֣���A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ������������������B�ǵؿ��к�������Ԫ�أ���֪A��C��B��E�ֱ���ͬ����Ԫ�أ���B��E��Ԫ��ԭ�Ӻ���������֮����A��C��Ԫ��ԭ�Ӻ���������֮�͵�2��������ͬ���ڵ�C��D��EԪ���У�D�Ǹ����ڽ���Ԫ���н�����������Ԫ�أ�
��1���ԱȽ�C��D��Ԫ������������Ӧˮ������Ե�ǿ�����ѧʽ��
�� ��
��2��A��B��C�γɵĻ�����ľ�������Ϊ ������ʽΪ ��
��3��д��D������CԪ������������Ӧˮ���ﷴӦ�����ӷ���ʽ ��
��4��д�����־���A��B��C��E����Ԫ�صĻ���������Һ�����Ӧ����������������ӷ���ʽ ��
��5��A���ʺ�B�����ܹ��ɵ�أ��õ���ö���Ե缫����ŨKOH��Һ�������ֱ�ͨ��A���ʺ�B���ʣ�д���õ�ظ����缫��Ӧ����ʽ ��
��6��ͨ�������£� C������������Ӧˮ����2mol��E����������Ӧˮ����1mol��ϡ��Һ�䷴Ӧ�ų�������Ϊ114.6KJ����д����ʾ�������仯�����ӷ���ʽ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫�߿���ɽ�и�����ģ���ۻ�ѧ�Ծ��������棩 ���ͣ������
����������Ҫ�ɷ���TiO2������FeO��Fe2O3���Ʊ�TiCl4���̷��Ȳ�Ʒ��һ���ۺϹ�������ͼ���£�
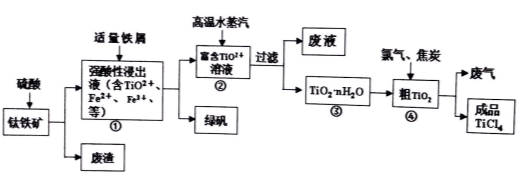
����ʾ��TiO2+��ˮ��ƽ��TiO2++��n+1��H2O TiO2��n H2O+2H+
TiO2��n H2O+2H+
�ش��������⣺
��1��������������ѷ�Ӧ�����ӷ���ʽ�� ��
��2����֪��TiO2��s��+2Cl2(g��=TiCl4(l��+O2(g�� ��H = +140 kJ��mol��1
2C(s��+ O2(g��=2CO(g�� ��H = -221 kJ��mol��1
д������TiO2�ͽ�̿��������Ӧ����Һ̬TiCl4 ��CO������Ȼ�ѧ����ʽ�� ��
��3�������м�����м������Һ����ɫ����ʱ��Һ�Գ�ǿ���ԡ��ù����������·�Ӧ������
A��2Fe3++Fe=3Fe2+
B��2 TiO2+(��ɫ�� +Fe+4H+��2Ti3+(��ɫ��+ Fe2++2H2O
C��Ti3+(��ɫ��+ Fe3++H2O��TiO2+(��ɫ�� +Fe2++2H+
I�������Ϣ�ж�Fe3+ ��TiO2+�� H+������ǿ���� > >
II��������������� ��
��4�������в���ͨ�����ˮ������ά����Һ����һ��ʱ�䣬����ˮ�϶������ѳ�����
���û�ѧƽ�����۷���ͨ�����ˮ���������ã� ��
��5��������ɫ��ѧ����ù��������д��ڵIJ���֮���� ��ֻҪ��д��һ���
��6���̷���Ħ������Ϊ278g/mol��������������ɫ���ϣ�Fe2O3����556akg�̷��������Ͽ�������ɫ����___mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������и�����ѧ�ڵ�һ���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ԭ����ij�л���Ľṹ��ʽ��ͼ��ʾ�����ڸ��л����˵������ȷ����
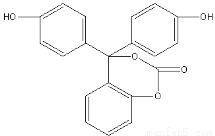
A�����л���Ļ�ѧʽΪC20H14O5
B�����л�������е��������������ܹ�ƽ��
C�����л���ɷ����ӳɡ�ȡ������������ȥ�ȷ�Ӧ
D��1mol���л���������NaOH ��Һ��ַ�Ӧ������NaOH�����ʵ���Ϊ5 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������и������¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
��16�֣�ʵ���������᳧��������Ҫ�ɷ�ΪFe2O3������FeS��SiO2�ȣ��Ʊ���������ʽ�������ľۺ����Fe(OH)(SO4)��n���̷�(FeSO4��7H2O)���������£�
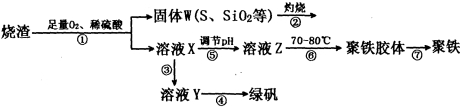
��1���ڢ�����֪FeS����Ԫ������Fe3+��SԪ�����ɵ�����д��FeS��O2��H2SO4��Ӧ�����ӷ���ʽ______________________________________��
��2�������̢��в���������ͨ��������Һ�У���Һ������ɫ����___________�����ţ���
A��Ʒ����Һ B������KMnO4��Һ
C����ɫʯ����Һ D����ˮ
��3���ڢ��У�������������___________________________��
��4���ڢ��У�����Ũ����Ҫ�Ĺ������������ƾ����⣬����___________________________��
��5���ڢ��У�����ҺZ���Ƶ�70��80���Ŀ����____________________________________��
��6��Ϊ����������Ʒ����Ԫ�ص�������������������ʵ�飨���������в�����Ԫ�غ���Ԫ�أ�����ȡһ��������Ʒ������Ʒ����������_________���ѧʽ����ͬ�����μӹ�����__________��������������ij��������ˡ�ϴ�ӡ�����������������������þ�����Ʒ����Ԫ�ص�����������
��7�����ò���ۢ���ȡ�̷����ⶨ3g����������������������
��ȡ�����̷���Ʒ���ܽ⣬���Ƴ�1000mL��Һ����ȡ25.00mL������Һ����ƿ�У�������Һʱ��Ҫ�IJ�������������������Ͳ���ձ�����ͷ�ι��⣬���� ��
���������ữ��0.01000mol/L KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ15.00mL���жϴ˵ζ�ʵ��ﵽ�յ�ķ����� �����ڵζ��յ��ȡ�ζ��̶ܿ�ʱ������KMnO4��ҺҺ�棬������������ȷ����ʹ�ⶨ��� ���ƫ�ߡ���ƫ�͡�����Ӱ�족����
�ۼ�����������Ԫ�ص���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������и������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ�������ֵ�������й�˵����ȷ����
A����ӦKIO3+6HI��KI+3H2O+3I2 ������3mol I2ת�Ƶ��ӵ�����Ϊ6NA
B����״���£���0.4 mol H2O2����O2ת�Ƶĵ�����ĿΪ0.2NA
C��12gʯī��C60�Ļ��������������Ϊ6NA
D�������£�1L pH��13��NaOH��Һ�У���ˮ�����OH�� ������ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ�����и�����ѧ��һģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ����
A��̼�����ˮ��������
HCO3��+H2O 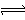 H3O++CO32��
H3O++CO32��
B������������Һ�м��������ˮ��Ag����NH3��H2O��AgOH����NH4��
C��Ũ�Ⱦ�Ϊ0.1mol��L-1������������Һ��̼�������Һ��������Ba2++2OH��+NH4++ HCO3��=BaCO3��+NH3��H2O+H2O
D�������������Һ��ͨ������SO2���壺ClO����SO2��H2O��HClO��HSO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʦ���и������ߴ�ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��17�֣�
��1����ijһ��������ɱ���ܱ������з������·�Ӧ��A(g)+B(g)
 2C(g) ��H < 0��t1ʱ�̴ﵽƽ�����t2ʱ�̸ı�ijһ�������䷴Ӧ������ͼ������˵����ȷ���� ���������ĸ��
2C(g) ��H < 0��t1ʱ�̴ﵽƽ�����t2ʱ�̸ı�ijһ�������䷴Ӧ������ͼ������˵����ȷ���� ���������ĸ��
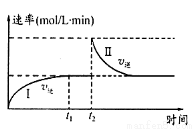
a��0��t1ʱ��v��>v�� ��t2ʱ��v��>v��
b�����������ܶȲ��ٸı�ʱ���������̴ﵽƽ��
c��t2ʱ�̸ı���������������ܱ������м�C
d���������̴ﵽƽ��ʱ��ƽ�ⳣ����<��
��2����ҵ�ϳ���CO2��NH3ͨ�����·�Ӧ�ϳ�����[CO(NH2)2]��
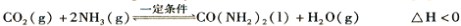
t��ʱ�����ݻ��㶨Ϊ2L���ܱ������м���0.10 molCO2��0. 40 molNH3��70 min��ʼ�ﵽƽ�⡣��Ӧ��CO2 ( g)�����ʵ�����ʱ��仯���±���ʾ:
ʱ�䣯min | 0 | 20 | 70 | 80 | 100 |
n(CO2) ��mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
��20 minʱ��ƽ����Ӧ���ʦ� (CO2 )= mol/L��min��
����100 minʱ�����������������䣬���������г���0. 050 mo1CO2��0. 20 molNH3�����½���ƽ���CO2��ת������ԭƽ����Ƚ� (����������䡱��С��)��
���������淴Ӧ��ƽ�ⳣ��Ϊ_ (����һλС��)��
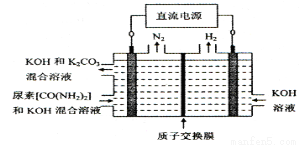
����ͼ��ʾװ��(����������Ϊ���Ե缫)�����ڵ�����ء�CO(NH2)2���ļ�����Һ��ȡ��������װ���������ĵ缫��ӦʽΪ ��
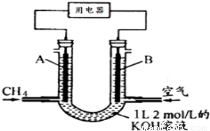
��3��CH4ȼ�ϵ�أ�װ��ʾ����ͼ��A��BΪ�����̼����������ͨ����飬�ڱ�״���£����ļ������VL���� V=44.8 Lʱ������ܷ�Ӧ����ʽΪ ���øõ��Ϊ��Դ����ʯī���缫���������ʵ����������Һ���������������ݡ�������⣬��������������Һ�л��ɹ۲쵽��������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ��ׯ�и���4��ģ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��X��Y��Z��W��M���ֶ�����Ԫ�أ�����X��Y��Z��Wͬ���ڣ�Z��Mͬ���壻X+��M2-������ͬ�ĵ��Ӳ�ṹ�����Ӱ뾶��Z2-��W-��Y�ĵ��ʾ����۵�ߡ�Ӳ�ȴ���һ����Ҫ�İ뵼����ϡ�����˵���У���ȷ����
A��X��M����Ԫ��ֻ���γ�X2M�ͻ�����
B������W��Z��MԪ�ص�����������Է����������μ�С��������е����ν���
C��Ԫ��Y��Z��W�ĵ��ʾ�������ͬ�����͵ľ���
D��Ԫ��W��M��ijЩ���ʿ���Ϊˮ�����е�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��ɳ�и���5��һģ��ѧ�Ծ��������棩 ���ͣ������
��13�֣�SO2��NO�Ǵ�����Ⱦ�����SO2 ��NO�����Na2S2O4��NH4NO3��Ʒ������ͼ���£�CeΪ��Ԫ�أ���
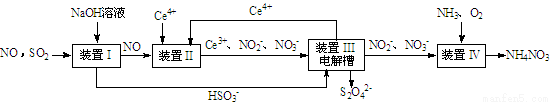
��1��װ�â�������HSO3�������ӷ���ʽΪ ��
��2�����������H2SO3��HSO3����SO32����������SO2��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�������X(i)����ҺpH �Ĺ�ϵ��ͼ��ʾ��
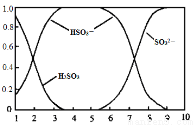
������˵����ȷ���� ������ĸ��ţ���
a��pH=8ʱ����Һ��c(HSO3��) < c(SO32��)
b��pH=7ʱ����Һ��c(Na+) =c(HSO3��)+c(SO32��)
c��Ϊ��þ����ܴ���NaHSO3���ɽ���Һ��pH������4��5����
����pH=5��NaHSO3��Һ�еμ�һ��Ũ�ȵ�CaCl2��Һ����Һ�г��ֻ��ǣ�pH��Ϊ2���û�ѧƽ���ƶ�ԭ��������ҺpH���͵�ԭ�� ��
��3��װ�â��У����������£�NO��Ce4+�����IJ�����Ҫ��NO3����NO2����д������NO3�������ӷ���ʽ ��
��4��װ�â������֮һ������Ce4+����ԭ������ͼ��ʾ��
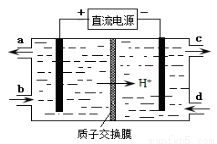
������Ce4+�ĵ缫��ӦʽΪ ��
������Ce4+�ӵ��۵� ������ĸ��ţ���������
��5����֪����װ�â�����Һ�У�NO2����Ũ��Ϊa g��L-1��Ҫʹ1 m3����Һ�е�NO2����ȫת��ΪNH4NO3����������װ�â���ͨ���״���µ�O2 L���ú�a����ʽ��ʾ������������������.
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com