
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a>b+1 | |
| C. | pH=9的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>③>② | |
| D. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |
分析 A.H2S溶液中分步电离;
B.氨水溶液中一水合氨存在电离平衡,加水稀释促进电离,一水合氨又电离出氢氧根离子;
C.酸性大小为CH3COOH>H2CO3>HClO,酸越弱对应生成的盐的水解程度越大,碱性越大;
D.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合,溶液中存在电荷守恒分析判断.
解答 解:A.H2S溶液中分步电离,H2S?H++HS-,HS-?H++S2-,溶液PH主要取决于第一步,c(H+)=1×10-5 mol•L-1;c(HS-)<1×10-5 mol•L-1 ,故A错误;
B.pH=a的氨水溶液,稀释10倍后,其pH=b,体积变化PH减小一个单位,氨水溶液中一水合氨存在电离平衡,又电离出氢氧根离子,则a<b+1,故B错误;
C.酸性大小为CH3COOH>H2CO3>HClO,酸越弱对应生成的盐的水解程度越大,碱性越大,pH=9的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③,故C错误;
D.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合,溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故D正确;
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较、电解质溶液中电荷守恒、弱电解质电离平衡影响因素分析、盐类水解原理的应用等知识点,掌握基础是解题关键,题目难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯的单体是CH2=CHCl | |
| B. | 通过加聚反应得到的聚乙烯属于天然高分子化合物 | |
| C. | 聚乙烯的链节是CH2=CH2 | |
| D. | 聚乙烯的产量是衡量一个国家石油化工发展水平的标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
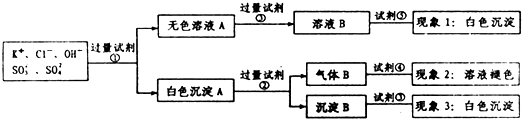
| A. | 试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl | |
| B. | 现象3中白色沉淀是BaSO4 | |
| C. | 试剂②是盐酸,试剂③是硝酸 | |
| D. | 产生现象2的离子方程式是:Br2+2H2O+SO2═4H++2Br-+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 | B. | 20 | C. | 12 | D. | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
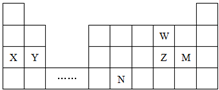
| A. | 原子半径:X>Y>W | |
| B. | 单质的氧化性:W>Z | |
| C. | 溴与元素M同主族,气态氢化物的稳定性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
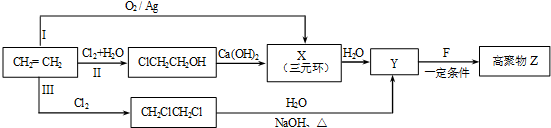
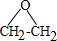 .
.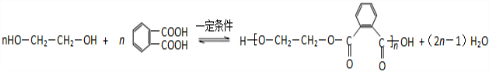 .
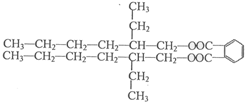
.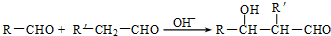 (R、R'代表烃基或氢原子).合成P的路线如下图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.
(R、R'代表烃基或氢原子).合成P的路线如下图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.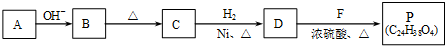
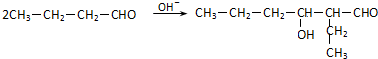 .
.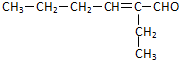 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
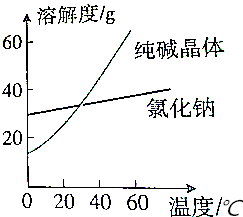
| A. | 蒸馏法 | B. | 苹取法 | C. | 结晶法 | D. | 分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com