
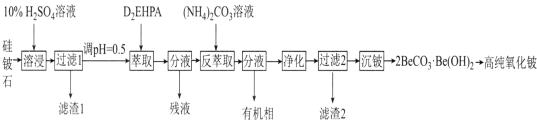
【题目】氧化铍(BeO)常温下为不溶于水、易溶于强酸和强碱的固体,除用作耐火材料外,还可以用于制霓虹灯和铍合金。工业上以硅铍石(主要含有BeO、SiO2、MgO,还含有少量Al2O3和Fe2O3)制备高纯度BeO的流程如图所示:
已知:①BeO为离子化合物,熔点为2350℃,BeC12和NaC1等比例混合的固体混合物在350℃即可熔化;
②不同金属阳离子在D2EHPA中的溶解性如下表所示:
Be2+ | Mg2+ | Fe3+ | Al3+ | |
D2EHPA中的溶解性 | 易溶 | 难溶 | 微溶 | 微溶 |
请回答下列问题:
(1)“滤渣1”的主要成分为__(填化学式)。“残液”中含量最多的金属元素为__(填名称)。
(2)“萃取”后铍元素以Be(HX2)2的形式存在于有机相中,“反萃取”后以(NH4)2Be(CO3)2的形式存在于水相中,则“反萃取”时含铍微粒发生反应的化学方程式为___。
(3)“净化”时需将反萃取液加热到70℃,加热到70℃的目的为__。
(4)由2BeCO3·Be(OH)2制备高纯BeO的方法是__。
(5)BeO的电子式为__。工业上常采用电解熔融BeC12与NaC1等比例混合物的方法制备金属Be,不采用电解熔融BeO制备的主要原因为___。
【答案】SiO2 镁 Be(HX2)2+2(NH4)2CO3=(NH4)2Be(CO3)2+2NH4HX2 使被萃取的少量Fe3+和Al3+水解为对应的氢氧化物而被除去 高温煅烧 ![]() BeO熔点高,熔融时能耗高,增加生产成本
BeO熔点高,熔融时能耗高,增加生产成本
【解析】
硅铍石主要含有BeO、SiO2、MgO,还含有少量Al2O3和Fe2O3,SiO2与硫酸反应不反应,加入足量稀硫酸得到BeSO4、MgSO4、Al2(SO4)3、Fe2(SO4)3溶液,滤渣1是SiO2;根据不同金属阳离子在D2EHPA中的溶解性表,“萃取”有机相含有Be(HX2)2及少量Fe3+、Al3+,“反萃取”后Be元素以(NH4)2Be(CO3)2的形式存在于水相中,水相经净化、过滤、沉铍得到2BeCO3·Be(OH)2,2BeCO3·Be(OH)2高温分解得BeO。
(1) BeO、SiO2、MgO、Al2O3和Fe2O3,只有SiO2与硫酸反应不反应,所以“滤渣1”的主要成分为SiO2。根据不同金属阳离子在D2EHPA中的溶解性表,Mg2+难溶于D2EHPA,“残液”中含量最多的金属元素为镁;
(2) “萃取”后铍元素以Be(HX2)2的形式存在于有机相中,“反萃取”后以(NH4)2Be(CO3)2的形式存在于水相中,则“反萃取”时Be(HX2)2和(NH4)2CO3反应生成(NH4)2Be(CO3)2,反应的化学方程式为Be(HX2)2+2(NH4)2CO3=(NH4)2Be(CO3)2+2NH4HX2;
(3) “净化”时需将反萃取液加热到70℃,加热促进水解,加热到70℃的目的是使被萃取的少量Fe3+和Al3+水解为对应的氢氧化物而被除去;
(4) 2BeCO3·Be(OH)2高温分解生成BeO和二氧化碳、水,由2BeCO3·Be(OH)2制备高纯BeO的方法是高温煅烧;
(5)BeO是离子化合物,电子式为![]() ; BeC12和NaC1等比例混合的固体混合物在350℃即可熔化,BeO为离子化合物,熔点为2350℃,BeO熔点高,熔融时能耗高,增加生产成本,所以工业上常采用电解熔融BeC12与NaC1等比例混合物的方法制备金属Be。
; BeC12和NaC1等比例混合的固体混合物在350℃即可熔化,BeO为离子化合物,熔点为2350℃,BeO熔点高,熔融时能耗高,增加生产成本,所以工业上常采用电解熔融BeC12与NaC1等比例混合物的方法制备金属Be。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染问题日益引起全民关注。
(1)PM 2.5是指大气中直径小于或等于2.5μm(1μm=100nm)的颗粒物。下列说法不正确的是_______(填字母代号)。
a.PM 2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM 2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,该新工艺既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
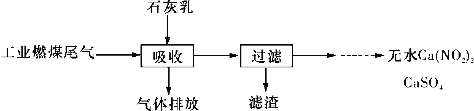
①CaSO4可以调节水泥的硬化时间,尾气中SO2与石灰乳反应生成CaSO4的化学方程式为_______________________________________________________。
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式为__________________________________________。
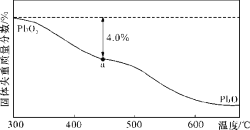
(3)空气中的铅污染可用火焰原子吸收分光光度法分析。已知PbO2在加热过程中发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0% ![]() 的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值。(结果保留一位小数)(要求写出计算过程)。____________
的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值。(结果保留一位小数)(要求写出计算过程)。____________
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面科普信息,回答问题:
一个体重50kg的健康人含铁2g,这2g铁在人体中以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是_________
A.Fe B.Fe2+ C.Fe3+
(2)工业盐中毒后,可以服用维生素C来缓解中毒状况,这说明维生素C具有______性。
(3)在Fe+4HNO3(稀)═Fe(NO3)3+NO+H2O↑的反应中,用双线桥法表示电子的转移____________,反应中HNO3表现出了______性和______性,则1molFe参加反应时,被还原的HNO3为_________mol,转移电子数为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-空气电池是一种新型燃料电池,其工作原理如图所示。下列说法错误的是( )
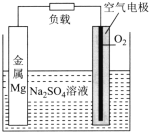
A.金属Mg电极为负极,其电势低于空气电极的电势
B.电子流向:Mg电极→导线→空气电极→电解质溶液→Mg电极
C.电池总反应为2Mg+O2+2H2O=2Mg(OH)2
D.回收后的氢氧化镁经一系列转化,可重新制成镁锭循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M由两种位于第四周期的过渡金属元素和一种位于第三周期的非金属元素组成,一定条件下M存在如图所示转化。已知:固体Y中两种金属元素的化合价分别为+2、+3。下列有关推断错误的是( )
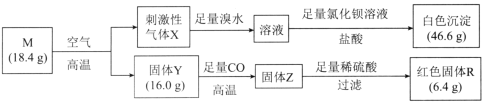
A.气体X能使品红溶液、酸性高锰酸钾溶液、含酚酞的碳酸钠溶液褪色
B.溴水吸收气体X的离子方程式为Br2+2H2O+SO22HBr+2H++SO![]()
C.根据上述数据推知,M的化学式为CuFeS2
D.向KNO3和稀盐酸的混合溶液中加入少量固体Z,固体Z全部溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A可作为水果催熟剂,D是一种合成高分子材料,G是一种有果香味的物质。现以C4H10为原料合成D、G的路线设计如下:
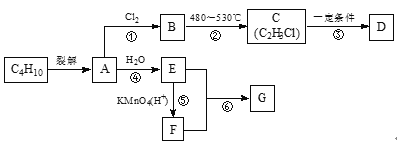
请回答下列问题:
(1)D的名称为___。反应②的反应类型是___。
(2)写出反应⑥的化学方程式:___。为加快⑥的反应速率,采取的措施有___。
(3)比C4H10多1个碳的同系物存在多种同分异构体,写出它们的结构简式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 ℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100 ℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)![]() 2NO2(g),下列选项不能说明上述反应在该条件下已经达到平衡状态的是( )
2NO2(g),下列选项不能说明上述反应在该条件下已经达到平衡状态的是( )
A. 烧瓶内气体的密度不再变化 B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化 D. 烧瓶内气体的平均相对分子质量不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com