
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L H2O中含有的原子数目为0.3NA
B.常温常压下,4.6 g NO2与N2O4混合气体中含有的氧原子数目为0.2 NA
C.0.1 molL-1 K2CO3溶液中含有的钾离子数目为0.2NA
D.0.lmol铁与足量氯气反应时,转移的电子数目为0.2 NA
科目:高中化学 来源: 题型:
【题目】柠檬酸(用HR 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
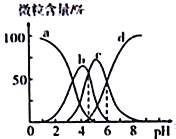
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 molL-1 KMnO4酸性溶液和②4 mL 0.2 molL-1 KMnO4酸性溶液中,分别加入4 mL 1 molL-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 加热2NO2(g) | 颜色加深 | 证明正反应是放热反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复旦大学教授吴宇平研制的水溶液锂电池体系,最终能实现电动汽车充电10秒即可行驶400公里的目标,其结构如图所示,则下列说法不正确的是
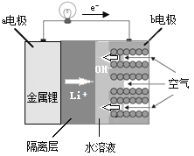
A.b电极采用多孔电极的目的是易于吸附气体
B.a电极为电池的正极,金属锂发生氧化反应
C.b电极的电极反应为O2+2H2O+4e-=4OH-
D.装置中用导电隔离层将电极锂与水溶液隔开的目的是防止金属锂与水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的方法正确的是
A.FeCl3溶液(CuCl2),加入Fe粉,过滤
B.CO2(SO2),通入饱和Na2CO3溶液中
C.NO(NO2),通入水中
D.Na2CO3溶液(Na2SO4),加入过量Ba(OH)2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛用途。如图是模拟工业制备氢溴酸粗品并精制流程:
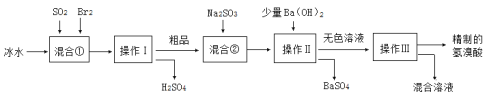
下列说法不正确的是
A.冰水的目的是降低反应温度,防止溴挥发,使反应更充分
B.混合①发生的反应为:SO2 +2H2O + Br2=H2SO4 + 2HBr
C.操作Ⅱ和操作Ⅲ的名称分别为过滤和蒸馏
D.Na2SO3的作用是调节溶液的pH也可以用Na2CO3替代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:称取25.0 g样品溶于稀硫酸中,加热搅拌,滤去不溶物。向滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得固体3.6 g。剩下滤液用2 mol·L-1的酸性KMnO4滴定,消耗KMnO4溶液25.00 mL。
(1)该铁矿石中铁元素的质量分数为________(保留三位有效数字);
(2)氧化物FemOn的化学式中m=____,n=____(m、n为正整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是

A. 放电时电流从石墨电极流向锌电极
B. 充电时阳极反应式为:3I--2e-=I3-
C. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)△H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
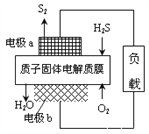
A. 电池在工作时,电流从电极a经过负载流向电极b
B. 电极a上发生的电极反应为: 2H2S - 4e- = S2 + 4 H+
C. 当反应生成64gS2时,电池内部释放632kJ热量
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com