
分析 (1)a保持容积不变,为等容变化,b保持内外压强相等,为等压变化,发生反应3A(g)+B(g)?2C(g)+D(g)是气体物质的量减少的反应,故b相当于在a平衡的基础上加压,平衡右移,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡,据此解答;
(2)将2 mol C和2 mol D充入a中相当于开始充入3 mol A+1 mol B,平衡时再充入1mol的D,平衡向消耗C的方向移动,所以C的浓度减少;
(3)若将4molC和2molD充入a中,相当于开始充入6 mol A+2 mol B,压强增大,平衡向右移动,反应物转化率增大,参加反应的A的物质的量大于原平衡的2倍,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡;
(4)要想达到平衡后a中C的浓度仍为N mol•L-1,与原体系是等效平衡,等温等容的条件下,相同物质的投料量相等;等温等压的条件下,相同物质的投料量相等.
解答 解:(1)a保持容积不变,为等容变化,b保持内外压强相等,为等压变化,发生反应3A(g)+B(g)?2C(g)+D(g)是气体物质的量减少的反应,故b相当于在a平衡的基础上加压,平衡右移,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡,故b中平衡时A的浓度大于a中A的平衡浓度,即M<m,故答案为:<;
(2)将2 mol C和2 mol D充入a中相当于开始充入3 mol A+1 mol B,平衡时再充入1mol的D,平衡向消耗C的方向移动,所以C的浓度减少,所以小于N mol•L-1,故答案为:<;
(3)若将4molC和2molD充入a中,相当于开始充入6 mol A+2 mol B,压强增大,平衡向右移动,反应物转化率增大,参加反应的A的物质的量大于原平衡的2倍,平衡时A的浓度小于原平衡的2倍,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡,故M<R<2M,
故选:C;
(4)保持温度不变,按下列比例分别充入a、b两容器中,达到平衡后a中C的浓度仍为N mol•L-1,一边倒转化为同一物质,物质的量相同④2molC+1molD ⑤1.5molA+0.5molB+1molC+0.5molD相当于3mol A、1mol B;要想b中C的浓度仍为n mol•L-1,转化为相同物质的物质的量成比例,①6molA+2molB、④2molC+1molD、⑤1.5molA+0.5molB+1molC+0.5molD转化为A与B的物质的量之比3:1,故选:④⑤;①④⑤.
点评 本题考查化学平衡移动与计算,难度中等,注意利用等效思想设计平衡建立的途径,(1)中A的浓度比较为易错点,学生容易根据平衡移动分析判断a中浓度大,忽略体积的减小,注意根据平衡移动原理或平衡常数理解.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 是否是大量分子或离子的集合体 | B. | 是否均一、透明、稳定 | ||
| C. | 是否能透过滤纸或半透膜 | D. | 分散质微粒直径大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中所含的离子是:Fe2+?Na+?SO42-?NO3-? | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体在空气中能变成红棕色 | |
| C. | 若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| D. | 若向该溶液中加入足量的NaOH 溶液,充分反应后,过滤?洗涤?灼烧,最终所得固体的质量为72g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐减小 | B. | 电子层数逐渐增多 | ||
| C. | 最高正化合价逐渐升高 | D. | 元素的非金属性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
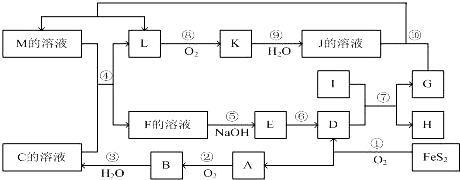
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
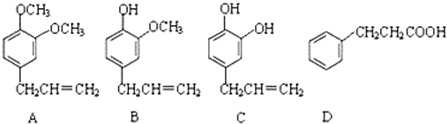
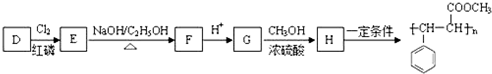
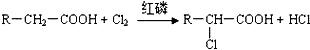
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素的原子序数呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素的金属性、非金属性呈周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com