
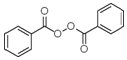
 也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程:
也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程: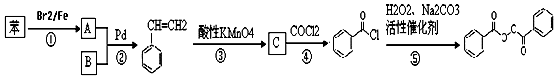
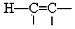 $\stackrel{Pd}{→}$
$\stackrel{Pd}{→}$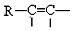
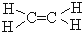 ;
;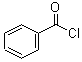 +H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$
+H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$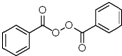 +2HCl;
+2HCl;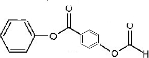 、
、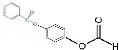 ;
; ;
; 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.分析 根据题中各物质的转化关系,结合信息提示,苯与Br/Fe发生取代反应生成A溴苯,溴苯与B发生取代反应生成苯乙烯,B为乙烯,苯乙烯被酸性高锰酸钾氧化生成C苯甲酸,苯甲酸与COCl2发生取代反应生成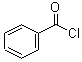 ,
, 与双氧水、碳酸钠在催化剂条件下生成
与双氧水、碳酸钠在催化剂条件下生成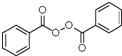 .D在一定条件下能发生银镜反应,且1molD最多可得到2molAg,说明该物质中含有一个醛基,分子中含有两个-COO-基团,因此D在酸性条件下的水解产物中共含有2个羧基和2个酚羟基,所以D中含有一个甲酸某酯,故D的结构简式有
.D在一定条件下能发生银镜反应,且1molD最多可得到2molAg,说明该物质中含有一个醛基,分子中含有两个-COO-基团,因此D在酸性条件下的水解产物中共含有2个羧基和2个酚羟基,所以D中含有一个甲酸某酯,故D的结构简式有 (邻、间、对)、
(邻、间、对)、 (邻、间、对),以苯乙烯为原料,合成
(邻、间、对),以苯乙烯为原料,合成 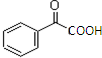 ,可以逆推法,要生成羰基和羧基→羰基和醛基→2个羟基→2个卤原子→烯烃的溴代反应,据此答题.
,可以逆推法,要生成羰基和羧基→羰基和醛基→2个羟基→2个卤原子→烯烃的溴代反应,据此答题.
解答 解:(1)反应①为取代反应,生成A为溴苯,根据提示中的反应原理可知B为乙烯,故结构式为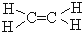 ,
,
故答案为 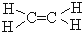 ;
;
(2)①②④为取代反应,反应③为氧化反应.故答案为:①②④;
(3)根据反应物和产物可知反应⑤为取代反应,方程式为 2 +H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$
+H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$ +2HCl,
+2HCl,
故答案为:2 +H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$
+H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$ +2HCl;
+2HCl;
(4)D在一定条件下能发生银镜反应,且1molD最多可得到2molAg,说明该物质中含有一个醛基,且该物质能发生水解反应,只含一种官能团,故该官能团只能为为酯基,又知1molD最多可消耗4molNaOH,因此D在酸性条件下的水解产物中共含有2个羧基和2个酚羟基,故D的结构简式有6种 (邻、间、对)
(邻、间、对) (邻、间、对),
(邻、间、对),
故答案为: ;
; ;
;
(5)该反应为聚合反应,类似1,3-丁二烯的聚合反应,方程式为
故答案为:
(6)逆推法,要生成羰基和羧基→羰基和醛基→2个羟基→2个卤原子→烯烃的溴代反应,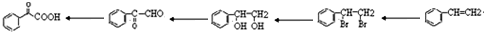
合成流程如下: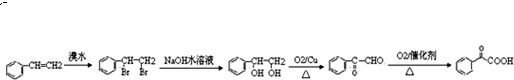
故答案为: .
.
点评 本题主要考查了增白剂的增白原理,酯类水解产物醇和酚的性质区别,以及两种烯烃的聚合反应.有机推断几乎是高考不变的一个题型,每年高考中必考,而给出某反应信息要求学生加以应用,能较好的考查考生的阅读、自学能力和思维能力,是热点题型.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 偏铝酸钠溶液:K+、NO3-、NH3•H2O | |
| B. | 空气:C2H6、CO2、SO2、NO | |
| C. | 硫酸铜溶液:H+、K+、S2-、Br- | |
| D. | 重铬酸钾钾溶液:H+、Na+、SO42-、乙醛分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系的变化 | 平衡时NH3的体积分数 | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ | W1 |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q kJ | W2 |
| A. | W1>W2,Q<23.15 | B. | W1=W2,Q=23.15 | C. | W1<W2,Q>23.15 | D. | W1=W2,Q<23.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃、101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 化石燃料在任何条件下都能充分燃烧 | |
| C. | 燃烧热或中和热是反应热的种类之一 | |
| D. | 弱酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
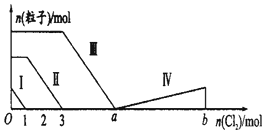 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法不正确的是( )
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法不正确的是( )| A. | 线段Ⅲ表示Br-的变化情况 | B. | 原溶液中n(FeI2):n(FeBr2)=1:3 | ||
| C. | 线段Ⅳ表示IO4-的变化情况 | D. | 根据图象可以计算a的值为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏的方法将自来水制成蒸馏水 | B. | 用过滤的方法除去食盐水中的泥沙 | ||
| C. | 用淘洗的方法从沙里淘金 | D. | 用酒精萃取碘水中的碘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com