

| 物质 | 沸点(℃) |
| 乙醇 | 78.5 |
| 乙酸 | 117.9 |
| 乙酸乙酯 | 77 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年山东省枣庄市高三1月月考理综化学试卷(解析版) 题型:选择题
化学与生产和生活密切相关,下列说法正确的是
A.14C可用于文物年代的鉴定,是12C的同素异形体
B.向含重金属离子的工业废水中加入明矾,然后再将废水排放
C.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
D.配制氯化亚锡(SnCl2)溶液时需加适量盐酸目的是防止其被氧化变浑浊
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列各组物质中,气体X和气体Y在通常条件下同时通入盛有溶液Z的洗气瓶中(如图所示),一定没有沉淀生成的是(已知常温下NaHCO3的溶解度小于Na2CO3、NaCl、NH4Cl、(NH4)2CO3和NH4HCO3的溶解度)

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 化学事实 | 类推结论 |
| A | 铜丝在氧气中加热反应生成CuO | 铜丝在S蒸气中加热反应生成CuS |
| B | 常温下,pH=2的稀盐酸加水稀释至100倍后溶液的pH变为4 | 常温下,pH=2的醋酸溶液加水稀释至100倍后溶液的pH变为4 |
| C | 同一周期从左到右,主族元素非金属性逐渐增强 | 同一周期从左到右,主族元素的电负性逐渐增大 |
| D | 除去Na2CO3粉末中混有少量的NaHCO3,看采用充分加热的方法 | 除去碘粉末中混有少量的NH4Cl,看采用充分加热的方法 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(I-)=0.1 mol/L的溶液中:Ca2+、NO3-、Fe3+、Cl- |
| B、SO2饱和溶液中:NH4+、K+、CO32-、ClO- |
| C、放入镁带有气体逸出的溶液中:Na+、K+、Cl-、SO42- |
| D、水电离出c(H+)=1×10-10mol/L溶液中:Cu2+、Na+、S2-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A) |
| B、1mol?L-1CH3COONa溶液与0.5mol?L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+) |
| C、0.1mol?L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3?H2O)+c(Fe2+)=0.3mol?L-1 |
| D、物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN-)+2c(OH-)=2c(H+)+c(NCN) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该物质的分子式为C16H16O3 |
| B、该物质分子内所碳原子有可能在同一平面内 |
| C、该物质可发生加成、取代、氧化等反应 |
| D、该物质可使酸性高锰酸钾溶液和溴水褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
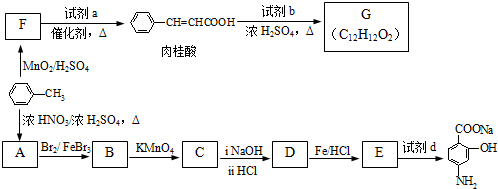
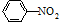
| Fe/HCl |
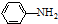
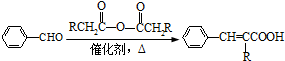 (R=-CH3或-H)
(R=-CH3或-H)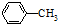
| MnO2/H2SO4 |
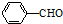
 生成A的反应类型是
生成A的反应类型是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸中:K+、Mg2+、Fe2+、MnO4-、 |
| B、NaOH溶液中:Cu2+、NH4+、SO42-、CO32- |
| C、FeCl3溶液中:Al3+、Na+、SCN-、SO42- |
| D、NaClO溶液中:K+、SO42-、OH-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com