
铅蓄电池是典型的可充型电池,电池总反应为:Pb+PbO2+4H++2S 2PbSO4+2H2O。
2PbSO4+2H2O。
请回答下列问题(不考虑氢、氧的氧化还原):
放电时,正极的电极反应是 ;电解液中H2SO4的浓度将变 ;当外电路通过1 mol电子时,理论上负极板的质量增加 g。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高二化学人教版选修四 5化学反应速率练习卷(解析版) 题型:选择题
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
A.0.1 sB.2.5 sC.10 sD.5 s
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 22电解原理的应用练习卷(解析版) 题型:选择题
关于镀铜和电解精炼铜,下列说法中正确的是( )
A.都用粗铜作阳极、纯铜作阴极
B.电解液的成分都保持不变
C.阳极反应都只有Cu-2e- Cu2+
Cu2+
D.阴极反应都只有Cu2++2e- Cu
Cu
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 20燃料电池练习卷(解析版) 题型:选择题
有四种燃料电池:A固体氧化物燃料电池;B碱性氢氧化物燃料电池;C质子交换膜燃料电池;D熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( )

查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 1化学反应与能量的变化练习卷(解析版) 题型:选择题
化学反应N2+3H2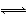 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g) 2NH3(l) ΔH=2(a-b-c)kJ·mol-1
2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) 2NH3(g) ΔH=2(b-a)kJ·mol-1
2NH3(g) ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g) NH3(l) ΔH=(b+c-a)kJ·mol-1
NH3(l) ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g) NH3(g) ΔH=(a+b)kJ·mol-1
NH3(g) ΔH=(a+b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 19一次电池 二次电池练习卷(解析版) 题型:选择题
已知蓄电池在放电时起原电池的作用,在充电时起电解池的作用。汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成。两个电极用稀硫酸作电解质溶液。在放电时,两极发生的反应可分别表示为:
Pb+S-2e- PbSO4
PbSO4
PbO2+4H++S+2e- PbSO4+2H2O
PbSO4+2H2O
充电时,两极发生的反应分别表示为:
PbSO4+2e- Pb+S
Pb+S
PbSO4+2H2O-2e- PbO2+4H++S
PbO2+4H++S
在蓄电池放电时,溶液的pH将( )
A.不变B.升高C.降低D.无法确定
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 18原电池练习卷(解析版) 题型:选择题
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量的CuSO4溶液,如各图中产生H2的体积V(L)与时间t(min)的关系,正确的是( )
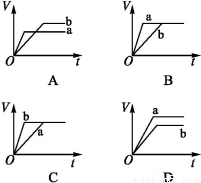
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 16盐类水解的应用练习卷(解析版) 题型:填空题
(1)25 ℃时,0.1 mol·L-1 NaOH溶液的pH为 ;
(2)25 ℃时,0.1 mol·L-1 NH4Cl溶液的pH 7(填“<”“=”或“>”),其原因是 (用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是 (填序号)。
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Na+)=c(Cl-)>c(OH-)>c(H+)
D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 12水的电离 溶液的酸碱性练习卷(解析版) 题型:选择题
已知25 ℃时KW=10-14,如果100 ℃时KW=5.5×10-13,这说明( )
A.100 ℃时水的电离程度较小
B.前者c(H+)较后者大
C.水的电离过程是一个吸热过程
D.100 ℃时0.1 mol·L-1 DCl的重水溶液中水的电离程度一定是室温时电离程度的10倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com