
科目:高中化学 来源:2013-2014学年山东省滨州市高三3月模拟(一模)考试化学试卷(解析版) 题型:填空题
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38oC时析出的晶体是NaClO2·3H2O,高于38oC时析出晶体是NaClO2,高于60oC时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。装置②反应容器为三颈烧瓶。
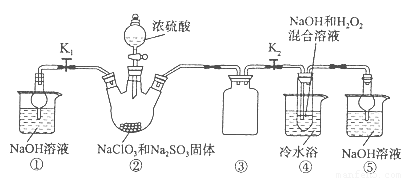
完成下列填空:
(1)组装好仪器后,检查整套装置气密性的操作是:??????????????????? 。
(2)装置②中产生ClO2的化学方程式为 ??????????????????????????????? 。
装置④中发生反应的离子方程式为????????????????????????????????? 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55oC蒸发结晶;②????? ;③????? ;④低于60oC干燥,得到成品。
(4)目前已开发出用电解法制取ClO2的新工艺。
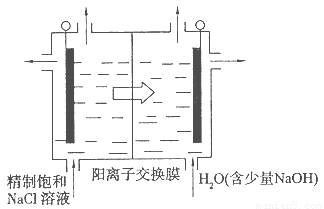
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生C1O2的电极反应为 ????????????? 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为??? mol。
(5)准确称取所得亚氯酸钠样品l0 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+C1-)。将所得混合液配成250 mL待测溶液。配制待测液需用到的定量玻璃仪器是????? ;取25.00 mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为?????????? 。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为???????? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用浓度为0.1 mol/L左右的KOH溶液滴定未知浓度的盐酸,有如下操作步骤:
(A)移取20.00 mL待测的盐酸注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用KOH溶液润洗滴定管2—3次
(C)把盛有KOH溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取KOH溶液注入碱式滴定管至0刻度以上2—3 cm
(E)调节液面至O或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用KOH溶液滴定至终点,记下滴定管液面的刻度
回答下列问题:
(1)正确操作的顺序是 (填编号)
(2)实验室可提供下列浓度的KOH浓液,应选用的是 。(填编号)
A.0.1 mol/L B.O.10 m01/L C.O.1032 mol/L
(3)(A)操作中量取待测液的仪器是 o
(4)(B)操作的目的是 .
(5)(F)操作中判断到达终点的现象是 。
(6)(B)如被省略所测结果 (填“偏大”、“偏小”、“不变”).
(7)KOH溶液在空气中易变质生成 ,该物质水溶液PH 7,其水溶液中离子浓度大小排序为
(8)(C)步如何使滴定管尖嘴充满溶液
查看答案和解析>>
科目:高中化学 来源:0115 竞赛题 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或对实验事实的叙述正确的是___________(填序号)。
①用碱式滴定管量取20.00 mL 0.10mol/L KMnO4溶液;
②用托盘天平称取10.50 g干燥的NaCl固体;
③各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量;
④将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH;
⑤焰色反应操作是:将铂丝放在稀盐酸中洗涤,然后蘸取待检物置于酒精灯或煤气灯的火焰上灼烧,观察火焰的颜色;
⑥中和滴定中,锥形瓶用蒸馏水洗净后可直接往其中注入一定量的待测溶液;
⑦用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com