
【题目】按要求回答下列问题。
(1)![]() 可溶解在
可溶解在![]() 溶液中的原因是____________________________________________________。
溶液中的原因是____________________________________________________。
(2)直接蒸发![]() 溶液,能不能得到
溶液,能不能得到![]() 晶体,其正确的操作__________________________。
晶体,其正确的操作__________________________。
(3)在![]() 溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的
溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的![]() 溶液,现象是_________________________________________________,请结合离子方程式,运用平衡原理进行解释:________________________________________________________________________。
溶液,现象是_________________________________________________,请结合离子方程式,运用平衡原理进行解释:________________________________________________________________________。
【答案】在![]() 溶液中存在
溶液中存在![]() ,加入Mg粉,Mg与
,加入Mg粉,Mg与![]() 反应放出
反应放出![]() ,使溶液中
,使溶液中![]() 降低,水解平衡向右移动,使Mg粉不断溶解 不能,应在
降低,水解平衡向右移动,使Mg粉不断溶解 不能,应在![]() 气流中加热蒸发 产生白色沉淀,且红色褪去 在
气流中加热蒸发 产生白色沉淀,且红色褪去 在![]() 溶液中,
溶液中,![]() 水解:
水解:![]() ,加入
,加入![]() 后,
后,![]() (白色),由于
(白色),由于![]() 减小,
减小,![]() 水解平衡左移,
水解平衡左移,![]() 减小,红色褪去
减小,红色褪去
【解析】
(1)氯化铵水解显酸性,Mg会与氢离子发生反应,故答案为:在![]() 溶液中存在
溶液中存在![]() ,加入Mg粉,Mg与
,加入Mg粉,Mg与![]() 反应放出
反应放出![]() ,使溶液中
,使溶液中![]() 降低,水解平衡向右移动,使Mg粉不断溶解;
降低,水解平衡向右移动,使Mg粉不断溶解;
(2)氯化铜溶液中存在铜离子的水解![]() ,故答案为:不能,应在
,故答案为:不能,应在![]() 气流中加热蒸发;
气流中加热蒸发;
(3)在![]() 溶液中,
溶液中,![]() 水解:
水解:![]() ,加入
,加入![]() 后
后![]() (白色),由于
(白色),由于![]() 减小,
减小,![]() 水解平衡左移,
水解平衡左移,![]() 减小,红色褪去;故答案为:红色褪去,生成白色沉淀;在
减小,红色褪去;故答案为:红色褪去,生成白色沉淀;在![]() 溶液中,
溶液中,![]() 水解:
水解:![]() ,加入
,加入![]() 后,
后,![]() (白色),由于
(白色),由于![]() 减小,
减小,![]() 水解平衡左移,
水解平衡左移,![]() 减小,红色褪去。
减小,红色褪去。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如下:
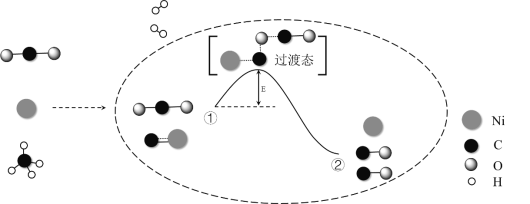
下列说法不正确的是
A. 合成气的主要成分为CO和H2
B. ①→②既有碳氧键的断裂,又有碳氧键的形成
C. ①→②吸收能量
D. Ni在该反应中做催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。
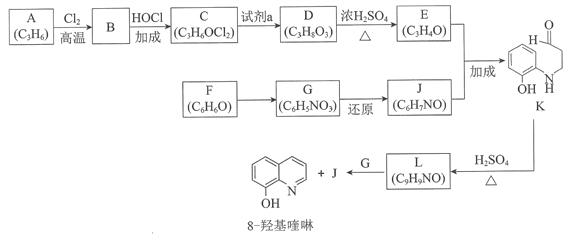
已知:i. 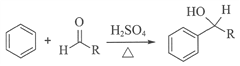
ii.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是__________。
(2)A→B的化学方程式是____________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)D→E的化学方程式是__________。
(6)F→G的反应类型是__________。
(7)将下列K→L的流程图补充完整:____________
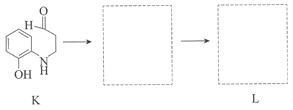
(8)合成8羟基喹啉时,L发生了__________(填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似。下列对NCl3和NH3的有关叙述正确的是( )
A.NCl3的沸点高于NH3的沸点
B.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3H2O分子,则NH3H2O的结构式为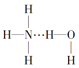
C.NCl3分子是非极性分子
D.NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0.100 mol/L NaOH溶液滴定20.00 mL、0.100 mol/L HC1溶液所得到的滴定曲线。
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b
D.图Ⅳ表示反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线
B.图2所示,石墨的熔点比金刚石低
C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3
D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山銀山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:①![]()
![]()
②NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)
N2(g)+CO2(g)![]()
③2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]()
反应![]() 的
的![]() ________
________![]() ;某温度下,反应①②③的平衡常数分別カ
;某温度下,反应①②③的平衡常数分別カ![]() 、
、![]() 、
、![]() ,则该反应的K=________(用
,则该反应的K=________(用![]() 、
、![]() 、
、![]() 表示)。
表示)。
(2)温度为![]() ℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
![]()
![]() ,测得有关实验数据如下:
,测得有关实验数据如下:
容器编号 | 物质的起始浓度( | 物质的平衡浓度( | |
|
|
| |
Ⅰ |
|
|
|
Ⅱ |
|
| |
Ⅲ |
|
| |
Ⅳ |
|
| |
①平衡时,容器Ⅱ与Ⅳ容器的总压强之比___________。
②温度不变,容器Ⅲ中达到平衡后再充入NO、![]() (g)各
(g)各![]() mol,则反应将向_____________。(填“正”或“逆”)方向进行。
mol,则反应将向_____________。(填“正”或“逆”)方向进行。
(3)常温下用0.100![]() 盐酸分别滴定10.00mL浓度均为0.100
盐酸分别滴定10.00mL浓度均为0.100![]() 的NaOH溶液和二甲胺[
的NaOH溶液和二甲胺[![]() ]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。
]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。

①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于![]()
![]() 的是________________,原因为_____________________。
的是________________,原因为_____________________。
②化学反应往往伴有热效应若为绝热体系a的温度______________(填“>”,“=”或“<”)c点的温度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 L含有0.4 mol Cu(NO3)2和0.4 mol KCl的水溶液,用惰性电极电解一段时间后,在一电极上析出19.2 g Cu。此时,在另一电极上放出气体的体积在标准状况下为(不考虑产生的气体在水中的溶解)( )
A.6.72 LB.13.44 LC.3.36 LD.5.6 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com