
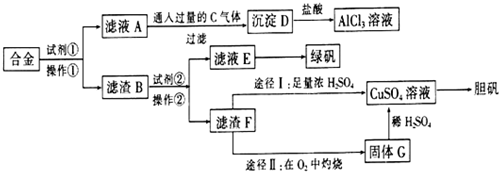
分析 废合金(含有铝、铁、铜)粉末制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,铝可与氢氧化钠反应,当合金与氢氧化钠反应时,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所以试剂①为NaOH溶液,操作①为过滤,所得滤液A为NaAlO2溶液,通入气体C为CO2,得沉淀D为Al(OH)3,Al(OH)3再溶于盐酸得氯化铝溶液,滤渣B为铁、铜混合物,铁能溶于稀硫酸得硫酸亚铁,所以试剂②为硫酸,操作②为过滤,滤液E为硫酸亚铁溶液,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,经途径Ⅰ与足量浓硫酸反应可生成硫酸铜溶液,途径Ⅱ将铜在空气中加热氧化成氧化铜,再与稀硫酸反应得硫酸铜溶液,硫酸铜溶液经蒸发浓缩、冷却结晶可得硫酸铜晶体,可用于制备胆矾,以此解答该题.
解答 解:(1)根据上面的分析可知,所加试剂①、②分别是 NaOH、H2SO4,合金加入试剂①反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,
故答案为:NaOH;H2SO4;2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
(2)操作①的名称为过滤,所用的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:过滤;烧杯、漏斗、玻璃棒;
(3)A→D反应离子方程式为[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-,
故答案为:[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-;
(4)根据上面的分析可知,滤液E经蒸发浓缩、冷却结晶得绿矾晶体,然后再经过滤、洗涤、干燥即得成品,洗涤时,为防止因溶解而造成硫酸亚铁的损失,最好用酒精,故选c,
故答案为:冷却结晶;c;
(5)由滤渣F制CuSO4溶液,途径Ⅰ与足量浓硫酸反应可生成硫酸铜溶液,同时会生成二氧化硫,会污染空气,且消耗硫酸的量多,途径Ⅱ将铜在空气中加热氧化成氧化铜,没有污染,且消耗硫酸的量少,所以最佳途径是途径Ⅱ,
故答案为:途径Ⅱ;途径Ⅰ消耗H2SO4的量多,且产生污染环境的SO2气体(或途径Ⅱ消耗H2SO4的量少,且不产生污染环境的SO2气体).
点评 本题综合考查物质的制备和性质探究等知识,侧重于学生的分析能力、实验能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质,难度中等.


科目:高中化学 来源: 题型:实验题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
| 相对式量 | 112.5 | 147 | 162.5 | 128 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水、次氯酸都属于弱电解质 | |
| B. | 有同种元素组成的物质一定是纯净物 | |
| C. | NaHSO4在溶液中能电离出H+,所以NaHSO4是酸 | |
| D. | 侯氏制碱法法的工艺中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3是碱 | B. | NaHCO3是酸 | C. | NaHCO3是盐 | D. | NaHCO3是一元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能存在NaCl | B. | 可能存在Na2SO4 | C. | 一定存在FeCl3 | D. | 一定存在Ba(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com