
【题目】在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g)![]() xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指:
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指:
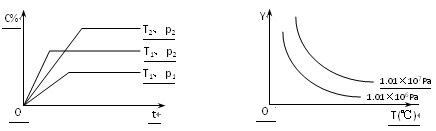
A.反应物A的物质的量 B.平衡混合气中物质B的质量分数
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
科目:高中化学 来源: 题型:
【题目】实验室用NaOH溶液捕获CO2。向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL。在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.
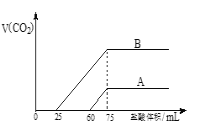
(1)曲线B表明原溶液中通入CO2后,所得溶液中的溶质为(写化学式)_____________,其物质的量之比为__________________。当耗盐酸0<v(HCl)<25 mL时发生的离子反应为:____________。
(2)曲线A表明,最初通入的CO2在标准状况下的体积为_________mL。
(3)通过计算求出原NaOH溶液的物质的量浓度______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
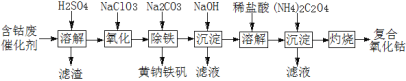
(1)用H2SO4溶解后过滤,得到的滤渣是____(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是____。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3 =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4 =Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是____。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:____。
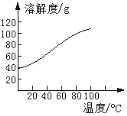
(5)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种公认的高热值清洁能源,目前世界各国正致力于将高污染高排放的碳能源过渡成清洁高效低排放的氢能源。氢能开发包括以下三个环节:
一、氢燃料的制备
(1)我国氢气的主要来源是焦炉气制氢,所制得的氢气含有较多的CO和H2S,中温干法脱硫是用氧化铁将硫元素转化为硫化铁。干法脱硫的反应方程式为________。
(2)我国科研人员用木屑水蒸汽气化制取氢燃料,在一定条件下,反应器中存在如下反应:
i.CO2 (g) +C(s)=2CO (g) △H1
ii.C(s) + H2O(g)=CO ( g) + H2 (g) △H2
iii.C(s) + 2H2 (g)=CH4( g) △H3
iv.CO(g) + H2O(g)=CO2 ( g) + H2 (g) △H4
v. CH4(g)+ 2 H2O(g)= CO2 ( g) + 4H2 (g) △H5
①△H5=_________________ 。
②研究中 CaO 的添加量按照CaO 中所含的Ca 和松木屑所含碳的物质的量比确定,在750℃,控制水蒸气流量为 0.lg/(ming)下,探究催化剂加入量对产气组分和气化性能的影响,结果如表所示:
n(Ca)/n(C) | 气体体积分数 | 碳转化率/% | |||
H2 | CO | CO2 | CH4 | ||
0 | 45.58 | 22.70 | 22.37 | 7.54 | 61.22 |
0.5 | 52.95 | 21.74 | 19.11 | 5.14 | 56.59 |
1.0 | 58.62 | 22.37 | 12.60 | 5.31 | 61.42 |
由表中数据,n(Ca) / n(C) =___时最为合理。 n(Ca) / n(C) 由0到0.5时,H2的体积分数显著增加的原因_____。体系的气化温度不仅对木屑的热解气化反应有影响 ,而且对 CaO 吸收 CO2 的能力以及 CaCO3的分解反应也有很大影响。实验过程中,控制 n(Ca) / n(C) 为 1.0,水蒸气流量为0.1 g/(min g), 将气化反应温度从700℃升到850℃,气化温度对产氢率、产气率的影响如表:
温度/℃ | 气体体积分数 | 碳转化率/% | ||
H2 | CO | CO2 | ||
700 | 51.78 | 20.75 | 19.89 | 54.37 |
750 | 58.62 | 22.37 | 12.60 | 61.42 |
800 | 55.63 | 26.05 | 12.71 | 73.43 |
850 | 54.16 | 26.94 | 13.82 | 83.34 |
③从产氢率的角度考虑,最佳操作温度是________________。
④随着反应的进行,发现 CaO 的吸收能力逐渐降低,原因是___________。
二、氢燃料的存储
(3)将氢气储存于液体燃料中,可以解决氢气的安全高效存储和运输问题。由于甲醇具有单位体积储氢量高、活化温度低等优点,是理想的液体储氢平台分子。我国学者构建一种双功能结构的催化剂,反应过程中,在催化剂的表面同时活化水和甲醇。如图是甲醇脱氢转化的反应历程( TS 表示过渡态)。
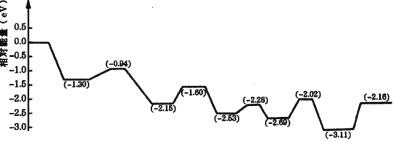
根据图像判断甲醇脱氢反应中断裂的化学键是______,该反应的△H___0( 填“大于”、“等于”或“小于”)
三、氢燃料的应用。一种氢能电池的原理如图:
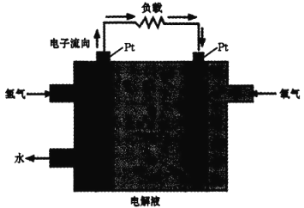
(4)正极的电极反应式为________。在 Pt 电极表面镜一层细小的铅粉,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A.盐酸与石灰石反应:CO32ˉ+2H+ = CO2↑+H2O
B.铁与稀盐酸反应:2Fe+6H+ = 2Fe3++3H2↑
C.氢氧化铁胶体的制备:FeCl3 + 3H2O = Fe(OH)3+3HCl
D.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解合成1,2-二氯乙烷的实验装置如图所示。下列说法中不正确的是
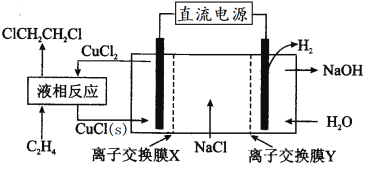
A.该装置工作时,阳极的电极反应是CuCl(s)+Cl--e-=CuCl2
B.液相反应为CH2=CH2+2CuCl2=ClCH2CH2Cl+2CuCl(s)
C.X、Y依次为阳离子交换膜、阴离子交换膜
D.该装置总反应为CH2=CH2+2NaCl+2H2O![]() ClCH2CH2Cl+2NaOH+H2↑
ClCH2CH2Cl+2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 ____________晶体;基态Ni原子的电子排布式为 _______________;
写出两种与配体CO互为等电子体微粒的化学式_____________、________________ 。
(2)某镍配合物结构如图所示,分子内含有的作用力有____________(填序号)。
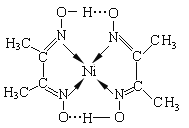
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应,
如①CH2=CH2、②HC ≡ CH、③ ![]() ④HCHO等,其中碳原子采取sp2杂化的分子有_________(填序号);HCHO分子的空间构型为:__________。
④HCHO等,其中碳原子采取sp2杂化的分子有_________(填序号);HCHO分子的空间构型为:__________。
(4)据报道,某种含有镁、镍和碳三种元素的晶体具有超导性,其结构如图所示。则该晶体的化学式为__________ 。晶体中每个镁原子周围距离最近的镍原子有 _________个。
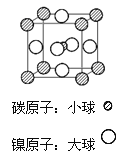
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填空:
(1)3.1 g Na2X含有Na+ 0.1 mol,则Na2X的摩尔质量为________
(2)当SO2、SO3的质量比为1∶1时,氧原子数之比为________
(3)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示电池是一种新型储氢材料—镍电池(MHn—Ni),(MHn中金属和氢都为 0 价)。下列有关说法不正确的是
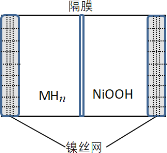
A.放电时正极反应为 NiOOH+H2O+e-→Ni(OH)2+OH-
B.电池的电解液可为KOH 溶液
C.充电时阴极反应为 MHn+nOH--e-→nH2O+M
D.MHn 是一类储氢材料,n 越大,电池的比能量越高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com