
科目:高中化学 来源: 题型:
一种气态烷烃与一种气态炔烃等体积混合,测得混合气体在标准状况下的密
度为1.25g/L,则构成这种混合气体的烷烃和炔烃可能是
A、甲烷,乙炔 B、甲烷,丁炔 C、乙烷,乙炔 D、乙烷,丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机物:①甲醛②乙醇③丙三醇④乙二醇⑤甲醇的沸点由高到低的顺序是( )
A.③>②>④>⑤>① B.③>④>②>①>⑤
C.④>③>②>⑤>① D.③>④>②>⑤>①
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A.①② B.①③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)====CO2(g)+3H2(g);△H=+49.0kJ·mol-1
②CH3OH(g)+1/2O2(g)====CO2(g)+2H2(g); △H=-192.9kJ·mol-1

下列说法正确的是
A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的 过程一定要吸收能量
过程一定要吸收能量
D.根据②推知反应CH3OH(1)+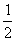 O2(g)====CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
O2(g)====CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2 (g) + 1/2O2(g) == H2O (l); △H = -285.8 KJ/mol
CO(g) + 1/2O2(g) == CO2(g); △H = -283.0 KJ/mol
C8H18 (l) +(25/2)O2(g) == 8CO2(g) + 9H2O (l); △H = -5518 KJ/mol
CH4 (g) + 2O2(g) == CO2(g) + 2H2O  (l); △H = -890.3 KJ/mol
(l); △H = -890.3 KJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A.H2 (g) B.CO(g)
C.C8H18 (l) D.CH4 (g)
查看答案和解析>>
科目:高中化学 来源: 题型:
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC≡CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH3CH=CH2(g) CH4(g)+HC≡CH(g) △H2=32.4 kJ·mol-1
CH4(g)+HC≡CH(g) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H3(g) CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________;放电时,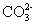 移向电池的_______(填“正”或“负”)极。
移向电池的_______(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3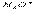
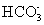 +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c( )(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定的溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、
②pH=11的溶液中: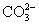 、Na+、AlO2-、NO3-
、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、ClO2-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
A.①②⑤ B.③⑤⑥ C.②④ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。
碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
请回答下列问题:
(1)碘是 (填颜色)固体物质,实验室常用 方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为 ;阴极上观察到的实验现象是 。
(3)电解过程中,为确定电解是否完成,需检验电解液中是 否有I—。请设计一个检验电解液中是否有I—的实验方案,并按要求填写下表。
否有I—。请设计一个检验电解液中是否有I—的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
| 实验方法 | 实验现象及结论 |
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:

步骤②的操作名称是  ,步骤⑤的操作名称是 。步骤④洗涤晶体的目的是 。
,步骤⑤的操作名称是 。步骤④洗涤晶体的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com