
①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,不正确的是
A.若将②、③溶液混合后,pH=7,则消耗溶液的体积:②=③
B.水电离的c(H+):①=②=③=④
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:①最大
D.向溶液中加入100mL水后,溶液的pH:③>④>②>①
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:2016届江西师大附中、临川一中高三上第一次联考化学试卷(解析版) 题型:选择题
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号 | 甲 | 乙 | 丙 |
① | CO2 | SO2 | 石灰水 |
② | HCl | CO2 | 石灰水 |
③ | CO2 | SO2 | Ba(NO3)2 |
④ | NO2 | SO2 | BaCl2: |
⑤ | CO2 | NH3 | CaCl2 |
A.②③④ B.②③④⑤ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第六次考试理综化学试卷(解析版) 题型:推断题
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。 E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3。(保留两位小数)
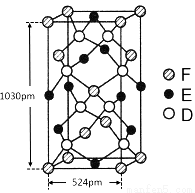
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列反应对应的离子方程式正确的是
A.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:
HCO3- + Ca2++OH-=CaCO3↓+H2O
B.过氧化钠溶于水:2022-+2H2O=4OH-+O2↑
C.用MnO2从酸化的海带灰中浸取液中提取碘:MnO2+2I-+2H2O=Mn2++I2+4OH-
D.向偏铝酸钠溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上12月月考化学试卷(解析版) 题型:选择题
现有物质的量浓度均为 0.1 mol·L - 1 的四种溶液各25mL:①氨水 ②NH4Cl 溶液
③Na2CO3溶液 ④NaHCO3溶液,下列说法正确的是:
A.4种溶液pH的大小顺序:①>④>③>②
B.①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3·H2O)
C.①、②中分别加入25mL 0.1 mol·L – 1盐酸后,溶液中c(NH4+):①>②
D.③、④中分别加入12.5mL 0.1 mol·L – 1NaOH溶液后,两溶液中离子种类相同
查看答案和解析>>
科目:高中化学 来源:2016届西藏自治区拉萨中学高三上学期第四次月考化学试卷(解析版) 题型:选择题
下列关于化学键的叙述,正确的一项是
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有极性键的分子一定是极性分子
D.含有共价键的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上第二次月考化学试卷(解析版) 题型:选择题
己知反应:① PbO2+4HCl=PbCl2+ C12↑+2H2O,②Cu+2Fe3+=Cu2++2Fe2+,③C12↑+2Fe2+=2 Fe3++2Cl-。则有关物质(离子)的氧化性由强到弱的顺序为
A.Cl2>Fe3+>Cu2+>PbO2 B. PbO2>Cl2>Fe3+>Cu2+
C. Fe3+>Cu2+>PbO2>Cl2 D. Cu2+>Fe3+> Cl2>PbO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期末模拟化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.氯化钾溶液在电流作用下电离成K+和Cl-
B.氧化还原反应的本质是有化合价的升降
C.依据丁达尔效应可将分散系分为溶液、胶体与浊液
D.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第二位
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上12月模拟化学试卷(解析版) 题型:选择题
已知Fe3O4纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具,水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH—=Fe3O4+S4O62-+2H2O,下列说法不正确的是
A.参加反应的氧化剂与还原剂的物质的量之比为1:5
B.若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
C.每生成1molFe3O4,则转移电子数为4mol
D.O2是氧化剂,S2O32-和Fe2+是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com