
| A. | KCl溶液与Na2CO3溶液反应:2K++CO32-═K2CO3 | |
| B. | 氧化镁与盐酸反应:MgO+2H+═Mg2++H2O | |
| C. | 碳酸氢钠与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 碳酸钠与氯化钙反应:Na2CO3+Ca2+═CaCO3↓+2Na+ |
分析 A.氯化钾与碳酸钠不发生反应;
B.氧化镁与盐酸反应生成氯化镁和水;
C.碳酸氢钠在溶液中电离出碳酸氢根离子,碳酸氢根离子不能拆开;
D.碳酸钠为易溶物,离子方程式中碳酸钠应该拆开.
解答 解:A.KCl溶液与Na2CO3溶液不满足离子反应发生条件,无法写出离子方程式,故A错误;
B.氧化镁与盐酸反应的离子方程式为:MgO+2H+═Mg2++H2O,故B正确;
C.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳气体和水,正确的离子方程式为:HCO3-+H+═CO2↑+H2O,故C错误;
D.碳酸钠与氯化钙反应生成碳酸钙沉淀,正确的离子方程式为:CO32-+Ca2+═CaCO3↓,故D错误;
故选B.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
 如图甲和乙是某学校王老师制备NH3并进行性质实验时的改进装置:
如图甲和乙是某学校王老师制备NH3并进行性质实验时的改进装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{2}$mol | B. | $\frac{b}{2}$mol | C. | ($\frac{a}{22.4}$-$\frac{b}{2}$)mol | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.4mol/L | C. | 0.3mol/L | D. | 0.15mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 气化和液化是使煤变成清洁能源的有效途径,煤的气化的主要反应是C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2,CO和H2的混合气体是合成多种有机物的原料气,研究由CO和H2合成有机物的化学称为一碳化学,如图是合成某些物质的路线图.
气化和液化是使煤变成清洁能源的有效途径,煤的气化的主要反应是C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2,CO和H2的混合气体是合成多种有机物的原料气,研究由CO和H2合成有机物的化学称为一碳化学,如图是合成某些物质的路线图. +2H2O;②A→B:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.
+2H2O;②A→B:2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对有气体参加的化学反应,通过减小体积增大体系压强,可使单位体积内活化分子数增加,因而反应速率增大 | |
| B. | 升高温度,主要是因为分子运动加剧,碰撞频率提高,因而反应速率增大 | |
| C. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| D. | 加入适宜的催化剂,可使活化能增大,从而加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ),试写出该两步反应对应的化学方程
),试写出该两步反应对应的化学方程 ;
;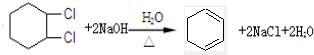 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com