
【题目】在溶液中能大量共存的离子组是
A. H+、OH-、Na+、Cl-
B. K+、NO3-、Cu2+、Cl-
C. Ba2+、SO42-、Na+、OH-
D. Fe3+、OH-、NH4+、HCO3-
科目:高中化学 来源: 题型:
【题目】用光洁的铂丝蘸取无色溶液在无色灯焰上灼烧时观察到黄色火焰,下列叙述正确的是( )
A.只含有Na+B.一定含Na+,也可含K+
C.既含Na+又含有K+D.可能含Na+或K+中一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为 11℃,可用于处理含硫废水。某小组在实验室中探究 ClO2 与 Na2S 的反应。回答下列问题:
(1)ClO2 的制备
已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4
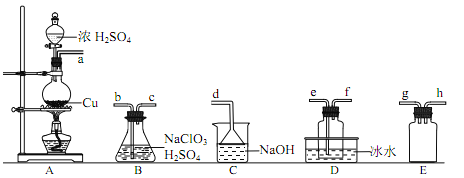
①装置 A 中反应的化学方程式为____________。
②欲收集干燥的 ClO2,选择上图中的装置,其连接顺序为 a→________________(按气流方向,用小写字母表示)
③装置 D 的作用是__________________。
(2)ClO2 与 Na2S 的反应
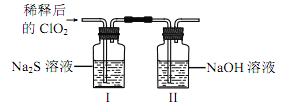
将上述收集到的 ClO2 用 N2 稀释以增强其稳定性,并将适量的稀释后的 ClO2 通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
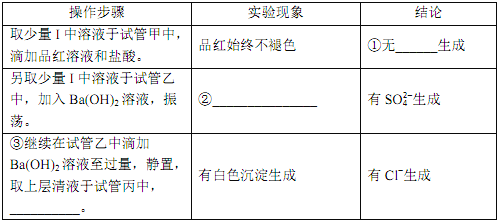
①___________。②___________。③___________。
④ClO2 与 Na2S 反应的离子方程式为____________。用于处理含硫废水时,ClO2 相对于Cl2 的优点是____________(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
A.常温常压下,16 g O3所含的氧原子数目为NA
B.1 molL﹣1CaCl2溶液中含有的Cl﹣数目为2NA
C.5.6 g Fe与足量盐酸反应失去的电子数目为0.3NA
D.标准状况下,22.4 L苯含有的分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I.C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
a.容器内混合物的质量不变 b.H2与H2O(g)的物质的量之比不再变化
c.混合气体的密度不再变化 d.形成 a mol H-H键的同时断裂 2 amol H-O键
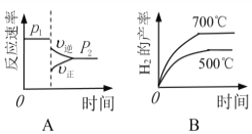
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
压强 温度 | p1/Mpa | p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
由表中数据判断:p1 ______ p2(填“>”、“<”或“=”)
下列图像正确的是_________。
(3)已知反应Ⅱ的△H= -41.1 kJ/mol, C=O、O-H、H-H的键能分别为803kJ/mol,464 kJ/mol、436 kJ/mol,则 CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向_____________(填“正反应”、“逆反应”)方向移动;当重新平衡后,CO2浓度_________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E是一种医药中间体,常用于制备抗凝血药,合成路线如下:

(1)A的结构简式为__________________________ ;
B中含氧官能团名称为______________、_______________;
(2)C转化为D的反应类型是_______________;
(3)写出D与足量NaOH溶液完全反应的化学方程式___________________________。
(4)1molE最多可与________molH2加成。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式 __________________;
A.能发生银镜反应 B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应,水解时1mol可消耗3molNaOH
(6)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。结合上述合成路线中有关信息,试写出以苯、甲苯为原料制取苯甲酸苯酚酯的合成路线流程图(无机原料任选)。合成路线流程图示例如下:
)是一种重要的有机合成中间体。结合上述合成路线中有关信息,试写出以苯、甲苯为原料制取苯甲酸苯酚酯的合成路线流程图(无机原料任选)。合成路线流程图示例如下:
![]() _________________________________________________________________________
_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的最高价氧化物的水化物是一种中强碱。甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2 ,它们之间的转化关系如下图所示(部分反应物省略),下列叙述正确的是

A. C、D两元素形成化合物属共价化合物
B. A、D分别与B元素形成的化合物都是大气污染物
C. C、D的简单离子均能促进水的电离
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.02mol铜片溶于100mL9mol/LHNO3中,产生336mL气体(只含NO、NO2)。该气体与一定量O2混合后用水恰好完全吸收,则通入的O2体积为(气体体积均为标准状况)( )
A. 22.4mL B. 33.6mL
C. 44.8mL D. 224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为72.0%、含氢为 6.67%,其余含有氧.现用下列方法测定该有机化合物的相对分子质量和分子结构.
方法一:用质谱法分析得知A的相对分子质量为150.
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3.如图A.
方法三:利用红外光谱仪测得A分子的红外光谱如图B.
试填空.
(1)A的分子式为 .
(2)A的分子中只含一个甲基的依据是(填序号).
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(3)A的结构简式为 .
(4)A的芳香类同分异构体有多种,其中符合下列条件:①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基.则该类A的芳香类同分异构体共有种.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com